경미한 증상의 고CK혈증을 보인 여성에서 진단된 Duchenne근디스트로피 보인자
A Paucisymptomatic HyperCKemia Patient Diagnosed with Manifesting Female Duchenne Muscular Dystrophy Carrier
Article information
고CK혈증(hyperCKemia)이 있으나 무증상(asymptomatic) 혹은 경미한 증상(paucisymptomatic)을 주소로 신경과에 내원하는 경우는 흔하다[1]. 고CK혈증의 원인을 평가하는 과정에 대해서 여러 연구와 권고안이 제시되어 왔는데[1], 최근 유전자 검사의 접근성이 향상됨에 따라 과거에는 특발성 고CK혈증으로 생각되었던 경우 중 다수에서 원인을 특정할 수 있게 되었다[2]. 환자는 경미한 증상의 고CK혈증이 있어 신경과에 내원한 여성으로, 여러 진단 평가 후에 Duchenne근디스트로피 여성 보인자로 확진된 증례이다.
증 례
21세 여성이 건강검진에서 발견된 간효소 수치 증가를 주소로 내원하였다. 사회력에서 음주력이나 약물 복용의 과거력은 없었다. 혈청 아스파트산아미노기전달효소, 알라닌아미노기전달효소와 총빌리루빈은 각각 134 U/L (참고 범위: <40 U/L), 91 U/L (참고 범위: <41 U/L), 0.3 mg/dL (참 고 범위: <1.2 mg/dL)였다. 내과에서 추가로 시행한 검사에서 복부 초음파는 이상이 없었고, 바이러스 간염의 증거도 관찰되지 않았으며, 항핵항체 1:160 homogenous 소견을 바탕으로 자가면역간염 의증 하에 간생검을 시행하였으나 특이 소견이 없었다. 6개월 후 환자는 크레아틴인산화효소(creatine kinase, CK) 증가를 이유로 신경과에 협진되었다. 신경학적 검진에서 근위약은 관찰되지 않았고 모든 근육에서 Medical Research Council Grade 5로 측정되었다. 감각기능과 심부건 반사도 정상이었다. 신경학적 진찰에서 특이 소견은 없었으나 10대 중반부터 주로 운동을 심하게 하고 난 후 양측 어깨와 허벅지에 통증이 간헐적으로 있었고, 피로감이 유독 심하여 20분 이상 운동을 하기 어려웠다고 하였다. 신경과에 입원하여 시행한 혈액검사에서 혈청 CK는 6,613 IU/L (참고 범위: 26-192 IU/L)로 측정되었다. 대사근병증을 배제하기 위한 아래팔허혈운동부하검사(forearm ischemic exercise test)를 시행하였으며 특이 소견은 없었다. 전기진단학적 검사에서 신경전도검사는 정상이었고, 침근전도검사에서 우측 상완이두근(biceps brachii), 삼각근(deltoid), 안쪽넓은근(vastus medialis)에서 짧은 지속 시간의 다상성의 운동 단위가 관찰되었고, 매우 드물게 양성예파가 동반되었다. 자기공명영상에서 가돌리늄 조영증강 지방억제 T1강조영상에서는 양측 긴모음근(adductor longus)에서 고신호를 보였고, 좌측 큰모음근(adductor magnus), 좌측 가쪽넓은근(vastus lateralis), 좌측 반막근(semimembranosus)에서 T1고신호강도가 비대칭적으로 관찰되었다(Fig. 1). 좌측 가쪽넓은근에서 근육조직검사를 진행하였다. 조직검사 결과, 헤마톡실린-에오신 염색에서 근섬유 크기가 중등증 이상으로 다양성을 보였고 면역조직화학염색에서 모자이크 양상으로 디스트로핀(dystrophin) 소실이 관찰되었다(Fig. 2). 차세대염기서열분석법을 이용한 근육병패널검사에서 DMD 유전자의 병원성 변이(pathogenic variant)가 이형접합으로 관찰되었다(c.8038C>T [p.Arg2680Ter], 참조서열: NM_004006.2). 미국의학유전학회의 권고에 의한 분류에서 해당 변이는 병원성 변이로 확인되었고(PVS1, PP5, PM2, PP3),3 표준전사방식(canonical transcript)을 기준으로 하였을 때 엑손(exon) 55 위치의 무의미변이(nonsense variant)가 예측되었다.
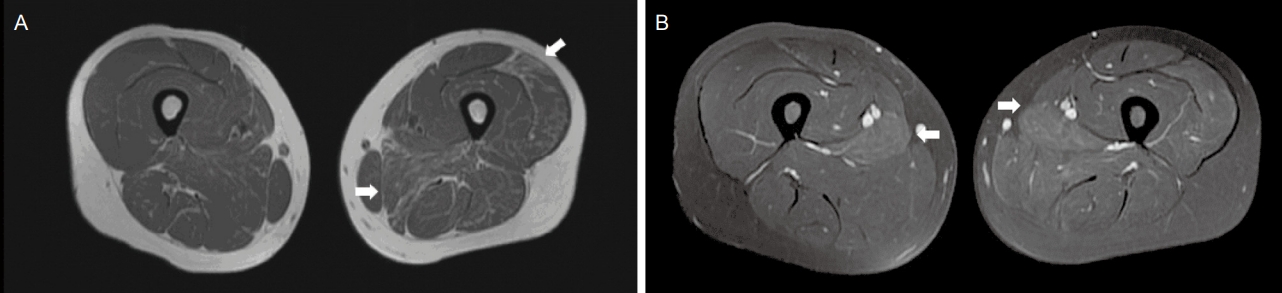
The axial magnetic resonance imaging at mid-thigh level of the patient. (A) The axial T1-weighted images show hyperintensities in the left vastus lateralis, adductor magnus, and semitendinosus muscles (arrows). (B) The fat-suppressed T1-weighted image with gadolinium enhancement reveals minimal enhancement in the adductor longus muscles, bilaterally (arrows).

The muscle biopsy from left vastus lateralis. (A, B) The moderate size variation of the muscle fiber and regeneration fibers are identified in hematoxylin & eosin stain (×200). The immunohistochemical staining against (C) C-terminus of dystrophin (×100) and (D) rod of dystrophin (×100) reveals dystrophin loss with mosaic pattern.
전기진단검사, 영상검사, 근육조직검사 및 유전자검사를 토대로 Duchenne근디스트로피 여성 보인자로 확진하였다. 환자 어머니의 경우 복합결찰의존탐색자증폭검사는 시행하지 못하였으나, 무증상이었고 스크리닝 목적으로 시행한 혈청 CK와 심전도는 정상이었다. 환자에게 향후 가족계획 시 유전상담이 필요함을 설명하였고 무리한 운동을 하지 않도록 교육하였으며, 정기적인 심장검사를 통해 부정맥을 조기에 발견할 수 있도록 권고하였다. 증례보고에 대해 환자로부터 서면동의서를 획득하였다.
고 찰
Duchenne근디스트로피는 주로 남아에서 호발하는 질환이지만, 8% 내외의 여성 보인자에서 증상을 보일 수 있다[4,5]. 환자의 경우 심한 운동을 한 경우에 주관적인 증상만을 호소하였고, 신경학적 진찰에서는 정상 소견을 보였으므로 최소한의 증상(paucisymptomatic hyperCKemia)을 보이는 증례로 볼 수 있다. 디스트로핀병증(dystrophinopathy)은 공통적으로 Duchenne근디스트로피, Becker근디스트로피 뿐만 아니라 증상이 발현된 여성 보인자(manifesting female carrier)의 경우에도 고CK혈증을 보이는 경우가 흔하다[4]. 이 증례의 경우에는 증상이 매우 경미하였기 때문에 진단 과정의 초기에 혈청 CK를 측정하지 않은 채 간효소 수치 이상을 염두에 둔 내과적 평가만 수행하게 되었고, 초음파 유도 하 간생검까지 시행된 바 있었다. 신경과 진료 시에 경미한 증상에도 불구하고 입원하여 평가를 시작하게 된 주요 요인은 고CK혈증이었다. 과거 연구에 따르면, 근육병이 의심되지만 가족력이 없는 고CK혈증을 동반한 여성의 10%에서 디스트로핀병증이 조직학적으로 확인되었다는 보고가 있다[6]. 최근 연구에서도 2차례 이상의 측정에서 특발성 고CK혈증이 확인된 환자들을 대상으로, DMD 유전자에 대한 복합결찰의존탐색자증폭검사와 Pompe병을 배제한 후, 근육병 차세대염기서열분석패널을 시행하여 50%의 환자에서 원인유전자가 발견되었다는 보고가 있다[2]. 따라서 경미한 근위부 근위약이나 근육통만 있는 환자라 하더라도 지속적인 고CK혈증이 발견되었을 때에는 디스트로핀병증 혹은 보인자 그리고 다른 유전성 근육병에 대하여 적극적인 평가가 필요하다.
본 증례에서 시행한 영상학적 검사와 근육조직검사 소견은 Duchenne근디스트로피 여성 보인자에서 흔히 보이는 특징에 부합하였다. 특히 자기공명영상 소견은 특징적이다. 환자에서 좌측의 큰모음근과 가쪽넓은근의 T1고신호강도가 뚜렷한데 비해 우측은 뚜렷하지 않아, 비대칭적인 근육 침범 양상을 나타내었다. Duchenne근디스트로피, Becker근디스트로피 등 다른 디스트로핀병증 환자에서는 근육 침범이 비교적 대칭적이지만, 여성 보인자에서는 비대칭적인 경우가 많은데 이는 발생 과정에서 나타나는 근육조직특이적(muscle tissue-specific)인 X염색체의 편향적 불활성화(skewed inactivation)로 인한 것으로 추정되고 있다[7,8] 근육조직검사에서도 디스트로핀 단백질의 소실이 모자이크 양상으로 관찰되었는데, 이를 통해 환자가 여성 Duchenne근디스트로피 보인자임을 확진할 수 있었다. 전술한 특징에도 불구하고, 여성 디스트로핀병증 환자들의 임상 양상과 증상의 중증도는 매우 다양하므로, 임상적 특징을 예단하기 어렵다[4,7]. 국내 보고에 따르면, 여성 보인자들의 진단 시 연령은 8개월 여아에서부터 30대 중반 이상의 성인까지 다양하였고[9], 증상은 무증상, 근육통, 경미한 근위부 위약, 종아리의 거짓비대 등에서부터 심장질환, 지능저하가 동반된 경우까지 다양하였다[7]. 본 증례의 환자는 비특이적인 증상을 호소하였고 객관적 신체 진찰 소견도 정상이었기 때문에, 병력과 임상 양상만을 토대로 환자를 진단하기는 사실상 불가능하였다.
Duchenne근디스트로피 여성 보인자의 조기 진단은 중요하다. 조기에 정확한 진단이 되어야 환자의 자녀에 대한 유전상담 및 산전 진단이 가능하고, 환자도 적절한 관리를 통해 운동 유발성 횡문근융해증, 심장질환 등 질병 관련 합병증이 발생하지 않도록 예방적 조치를 취할 수 있기 때문이다[10].