삼차신경통의 임상적 고찰
A Practical Review of Trigeminal Neuralgia
Article information
Trans Abstract
Trigeminal neuralgia (TN) is a highly disabling disorder characterized by very severe, brief, electric shocks, like recurrent episodes of facial pain. New diagnostic criteria classifying TN on the basis of the presence of trigeminal neurovascular conflict or an underlying neurological disorder can help better characterize patients and determine treatments. Magnetic resonance imaging using specific sequences should be a part of the diagnostic workup to detect a possible neurovascular contact and exclude secondary causes. Carbamazepine and oxcarbazepine are drugs of first choice for long-term treatment, whereas microvascular decompression is the first-line surgical management of medically refractory patients. This review aimed to review the classification, clinical features, pathophysiology, diagnostic approaches, and management of TN.
서 론
삼차신경통(trigeminal neuralgia)은 삼차신경(제5번 뇌신경)의 하나 이상의 분지 분포에서 편측성으로 전기 충격 같은 통증이 짧게 반복적으로 나타나며 무해한 자극에 의해 유발되는 것이 특징이다[1]. 삼차신경통은 얼굴을 만지거나 말하거나 먹고 마시는 등 기본적 신체활동에 영향을 주는 심각한 신경통으로 환자의 불안, 우울증, 수면 부족이 증가하여 정신 건강에 미치는 영향이 중대한 질환이다[2]. 본 종설에서는 삼차신경통의 진단과 치료를 중심으로 최신 지견을 기술하고자 한다.
본 론
1. 병인 기전
삼차신경은 얼굴의 감각과 저작근 운동에 관여하며, 안구(ophthalmic, V1), 상악(maxillary, V2), 하악(mandibular, V3)의 세 개 분지로 구성된다(Fig. 1). 삼차신경은 교뇌(pons)의 중간면에서 시작하여 감각신경절(gasserian ganglion)은 중간두개와(middle cranial fossa) 바닥에 있는 메켈(Meckel)동굴에 위치한다. 삼차신경뿌리의 압박이 삼차신경통의 주요 기전이며, 뇌간 병변도 드문 원인으로 알려져 있다.
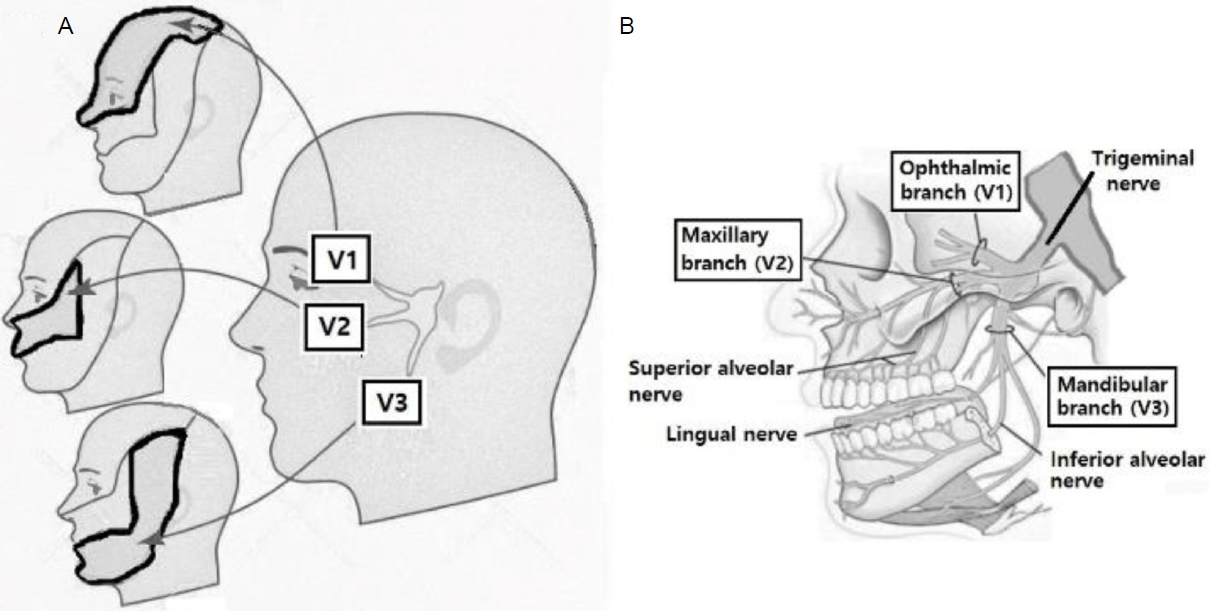
Anatomy of the trigeminal nerve (cranial nerve V). (A) Sensory distribution of the trigeminal nerve. (B) Three branches of the trigeminal nerve.
1) 삼차신경 신경뿌리(nerve root)의 압박
대부분의 삼차신경통은 교뇌(뿌리 진입 영역)로 들어가는 삼차신경의 압박에 의해 발생한다[3]. 동맥이나 정맥의 비정상적인 혈관 고리(vascular loop)에 의한 압박이 80-90%를 차지한다[3-7]. 삼차신경 압박의 다른 원인으로 전정신경초종(vestibular schwannoma), 수막종, 낭종, 드물게 동맥류 또는 동정맥 기형이 보고된 바 있다[8-14].
신경 압박이 증상을 유발하는 기전은 압박 부위 주변의 탈수초화와 관련이 있는 것으로 추정된다[15,16]. 정확히 어떻게 탈수초화가 삼차신경통 증상을 유발하는지는 명확하지 않지만, 탈수초 병변은 이소성 신경자극(ectopic impulse)을 일으켜 전기연접전달(ephaptic transmission)을 유발할 수 있는데, 가벼운 접촉을 매개하는 섬유와 통증 발생에 관여하는 섬유 사이의 전기연접 교차가 가벼운 촉각 자극에 의한 고통스러운 통증 생성을 일으키는 것으로 설명된다[3].
2. 역학
전체 유병률은 0.16-0.3%이며[24-27], 연간 발생률은 100,000명당 4-29명이고, 최근 대한민국 국민건강보험 자료를 활용한 연구에서는 100,000명당 100.21명으로 상당히 높게 보고된 바 있다[25,28]. 노인 인구에서는 자주 나타나는 신경통으로, 발생률은 나이가 들면서 점차 증가하여 80세 이상에서 가장 높은 발생률이 보고된다[24,25,28]. 대부분의 특발성 및 고전적 삼차신경통은 50세 이후에 시작되지만 20대 및 30대 또는 드물게 어린이에서도 발병할 수 있다[21,29]. 남성보다 여성 발생률이 더 높게 보고되어 남녀 발생률은 1:1.5에서 1:2.1이다[21,24,28]. 대다수의 환자는 산발적으로 나타나나 드물게 가족 사례가 보고되었다[30,31].
고혈압은 삼차신경통 발병의 위험요소가 될 수 있으며[32-35], 편두통이 삼차신경통의 위험인자라는 일부 보고도 있다[36].
3. 임상 특징
삼차신경통은 임상적으로 제5번 뇌신경(삼차신경)의 하나 이상의 가지 분포의 영역에서 강렬하고 날카로운 찌르는 듯한 양상의 반복적 통증 발작으로 정의된다.
1) 신경통 분포
통증은 삼차신경 영역에만 나타난다. 통증은 삼차신경의 V2 및 V3 분지에 흔히 발생하며, V1 분지의 단독 침범은 환자의 5% 미만에서 발생한다[1,2,24]. 세 개 분지가 모두 침범되는 경우가 14%, V2와 V3 동시 침범이 35%이며, V2 또는 V3 한 분지만 침범이 각각 17%, 19%로, 전체적으로 V3 분지 침범이 가장 흔하기에 환자들은 턱 주변의 통증으로 치과를 통해 내원하는 경우가 많다[37,38].
주로 편측으로 발생하며, 양측 침범은 2-5%로 드물다[21,24]. 쇼그렌 증후군, 유육종증, 전신홍반루푸스 등의 결합 조직 장애와 다발성경화증으로 인한 경우 양측 침범 발생한 보고가 있다[21,39].
2) 발작성 통증
발작적으로 발생하는 경향이 있으며 발병 시에 최대 강도이며, 심한 통증시 안면 근육 경련이 동반되기도 하여, 과거에는 고통스러운 틱(tic douloureux)이라고 불리기도 하였다[38]. 통증은 종종 전기적, 충격적 또는 찌르는 듯한 통증으로 묘사되고, 보통 1초에서 수초간 지속되며, 하루 0회에서 50회 이상의 빈도로 반복적으로 발생하고, 몇 분간의 통증 발작 유발이 안되는 불응기가 있다[2,27,37]. 장기간 삼차신경통을 가진 일부 환자에서는 통증 발작 사이에 지속적 둔통을 보이기도 한다[37]. 다른 안면 통증 증후군과 달리 통증으로 밤에 깨지는 않는다[37].
3) 통증 유발
환자들은 자극에 의해 유발되는 통증을 경험한다[2,27,37,40,41]. 신경통 영역 내에 유발점이 있으며 정중선(midline) 근처에 위치하는 경우가 많다[38,42]. 이 부위를 가볍게 만지면 종종 발작이 유발되어 환자가 이 부위를 잘 건드리지 못한다.42 다른 유발 요인으로는 씹기, 말하기, 양치질, 차가운 공기, 웃기, 찡그리기 등이 있다[24,42]. 가볍고 무해한 자극에 의한 통증 유발이 삼차신경통의 진단 기준에 포함되나, 자발적 통증도 환자의 68-98%에서 보고되며 삼킴이나 입술 움직임과 같이 일상적 동작에 의해서 유발되어서 유발 요인을 인식하지 못했기 때문일 수 있다[37].
4) 자율신경 증상
안구 분지(V1) 삼차신경통에서는 눈물, 결막충혈, 콧물 등 경미한 자율신경 증상이 통증 발작과 함께 발생하기도 한다[24,43,44]. 그러나 자율신경 증상이 두드러지거나 심할 경우에는 결막 충혈 및 눈물을 동반한 단기지속편측신경통형 두통발작(short-lasting unilateral neuralgiform headache attacks with conjunctival injection and tearing, SUNCT) 및 자율 증상을 동반한 단기지속편측신경통형두통발작(short-lasting unilateral neuralgiform headache attacks with autonomic symptoms, SUNA) 증후군을 시사하므로 감별진단에 유의해야 한다[42.43].
5) 지속적인 통증
발작 사이에 지속적 통증이 많은 환자들에서 나타난다[27]. 일반적으로 발작성 통증보다는 경미하며 둔함 또는 저릿거림 양상이며, 그 강도와 양상은 변동된다[27]. 158명 코호트에서는 환자의 49%에서 동반되는 지속성 통증이 있었다고 보고하였다[24].
둔하고 지속적이며 쑤시는 턱 통증이 시간이 지남에 따라 삼차신경통으로 진행한 사례들도 있다[45-47]. 이러한 짧고 경미한 턱의 통증은 때로 치아 원인으로 의심되어서 불필요한 치과 시술을 받게 되는 경우도 있다[48]. 반면, 치과 시술(예: 발치)에 의해 삼차신경통이 촉발되는 경우도 있어서 정확한 원인 파악이 어려운 경우도 있다[45].
6) 경과 및 예후
대개 통증은 몇 주 또는 몇 달 동안 지속되며, 그 후 몇 주에서 몇 년 동안 증상이 없는 간격이 이어지는 양상이다[2,38]. 대개 통증 완화기는 몇 달 동안 지속된다[31,37]. 재발이 매우 흔하며, 일부 환자는 지속적인 배경 안면 통증을 수반한다[2,31,37,38]. 통증 기간의 중앙값은 약 49일 정도이며, 그 후 몇 개월(36%), 몇 주(16%) 또는 심지어 며칠(16%)의 완화기로 이어지며, 6%에서만 1년 이상의 완화기를 보였으며, 약 20%에서는 끊임없는 발작을 경험하였다[31,37,38].
삼차신경통은 예후가 좋지 않은 진행성 질환으로, 환자의 90%에서 결국 발작 빈도와 중증도가 증가하는데, 약물에 대한 초기 반응이 약 70% 정도이고 5-16년 경과됨에 따라 약물 반응률은 20%로 떨어지며, 환자의 44%는 여러 약물을 조합하거나 대체 약물을 필요로 하였다[37]. 삼차신경통에 대한 순수한 자연사 연구는 없는데, 대개 통증이 심각해지면 중재 수술로 이어지기 때문이다[38].
4. 진단
1) 임상적 진단
진단은 삼차신경이 분포하는 영역에서 발생하는 전형적인 통증 발작을 기반으로 한다. 임상적으로 삼차신경통 진단이 의심되면 이차적 원인에 대한 조사를 해야 한다.
국제두통학회는 2018년 개정된 International Classification of Headache Disorders, Third Edition (ICHD-3)에서 삼차신경통의 진단 기준을 다음과 같이 기술하였다: [1] A) 삼차신경의 하나 이상의 분지 분포에만 국한된 편측성 안면 통증의 재발성 발작이면서, 진단기준 B와 C를 만족할 때; B) 다음 기술된 특성을 모두 가진 통증: (i) 1초에서 2분까지 지속됨, (ii)심한 강도, (iii) 전기 충격 같은, 총 맞은 것 같은, 찌르는듯한, 또는 날카로운 양상; C) 통증 발현된 삼차신경 분포 영역에 무해한 자극을 줄 때 유발됨; D) 다른 ICHD-3 진단명으로 더 나은 설명이 되지 않음.
2) 병인에 따른 분류
삼차신경통이 의심되는 모든 환자에서 원인 확인을 위해 신경영상이 필요하다[49]. 삼차신경반사검사(trigeminal reflex test)는 삼차신경통의 진단적 평가에 통상적으로 사용되지는 않으나 자기공명영상(magnetic resonance imaging, MRI)을 찍을 수 없는 환자와 MRI 상 이상이 없는 삼차신경통 의심 환자에게 도움이 될 수 있다[27].
ICHD-3에서는 삼차신경통을 원인에 따라 세 가지 하위 유형으로 분류한다[1].
(1) 고전적(classical) 삼차신경통
신경혈관 압박 외에는 다른 원인이 없이 발생한 삼차신경통이다[1]. 위의 ICHD-3 삼차신경통 진단기준을 충족하며, MRI 상 또는 수술 소견에서 신경혈관 압박(neurovascular compression)이 있으며, 삼차신경뿌리의 형태학적 변화를 동반한 경우로 정의한다[1,2]. 혈관 고리에 의한 삼차신경 압박과 관련이 있는 것으로 밝혀진 삼차신경통은 이론적으로는 ‘이차성(속발성, secondary)’으로 간주될 수도 있다[2]. 그러나 대부분의 환자는 혈관 압박에 대해 수술을 받지도 않고 또한 신경혈관의 접촉인지 또는 압박인지 불확실한 경우도 많기에, ICHD-3에서는 혈관 관련 압박 관련된 것으로 추정되며 전형적인 삼차신경통 양상인 경우 "일차성(primary)" 대신 "고전적"이라는 용어를 사용한다[2,38].
(2) 이차성(속발성, secondary) 삼차신경통
기저질환으로 인한 삼차신경통으로 정의한다[1,2]. 잘 알려진 원인으로는 다발성경화증, 소뇌교각 종양, 동정맥 기형, 결체조직질환 등이 있다[2,37,38]. 삼차신경통의 15%가 이에 해당한다[6,27]. ICHD-3에서는 대상포진 관련 삼차신경 영역의 통증의 경우는 따로 통증성 삼차신경병증으로 분류한다[37].
(3) 특발성(idiopathic) 삼차신경통
전기생리학적 검사나 MRI에서 이상을 보이지 않는 삼차신경통으로 정의하며, 전체 삼차신경통의 약 10%가 이에 해당한다[7,50]. 삼차신경 영역의 감각 상실 또는 양측 침범이 있는 경우, 더 어린 나이에 발병된 경우, 이차성 삼차신경통의 가능성이 더 높다[6]. 그러나 발병 연령대가 상당히 넓게 분포하기에 발병 연령은 고전적 삼차신경통과 이차성 삼차신경통 구별하기에는 임상적으로 유용한 예측인자가 아니며, 앞서 나열한 특별한 임상적 특징(감각 상실, 양측 침범, 젊은 연령 발병 등)이 없다고 해서 이차성 삼차신경통을 완전히 배제할 수도 없다[6,38].
3) 영상검사
신경혈관 압박 또는 구조적 뇌 병변을 확인하기 위해 조영증강 또는 비조영증강 MRI 촬영이 필요하다[2,38,51,52]. MRI가 불가능한 경우 두부 컴퓨터단층촬영(computed tomography)이 대안이 될 수 있지만, MRI가 해상도가 더 높아서 삼차신경과 주변 구조물을 잘 관찰할 수 있어서, MRI와 magnetic resonance angiography (MRA)가 훨씬 더 선호된다[2,38,51].
2) 영상을 통한 신경혈관 압박 진단
영상에서 삼차신경과 혈관이 접촉되어 있는 것만으로는 신경혈관 압박을 원인으로 확진 하기에는 불충분하며, 교뇌에서 나오는 부위 삼차신경의 전위, 변형, 위축, 압박 등의 형태학적 변화를 영상에서 확인하는 것이 필요하다[1,27].
메타분석 연구에 의하면 MRI/MRA에서 삼차신경의 신경혈관 접촉은 무증상 측에 비해 증상 측에서 더 빈번하게 관찰되었고(36% vs. 89%) [7], 혈관 접촉 부위에서 삼차신경의 해부학적 변화(즉, 위축, 변형 또는 편평화)도 무증상 측에 비해 증상이 있는 신경에서 더 빈번하였다(9% vs. 53%) [7]. 삼차신경뿌리 접촉만 있을 경우 민감도와 특이도가 각각 66%와 90%였으나, 삼차신경 뿌리의 접촉과 신경위축이 공존하는 경우 민감도는 낮지만(52%) 특이도는 100%로 증가되었다[52,56].
5. 감별진단
고전적 삼차신경통이 신경과 의사 또는 두통 전문가에 의해 최종 진단되기까지 평균 11개월이 소요되며, 질환 초기에 진단을 제대로 받지 못하는 경우도 42%나 된다[45]. 삼차신경통 진단 전 환자의 약 30-73%는 먼저 치과를 방문했다는 보고가 있을 정도로 치과 질환과의 감별진단이 중요하며, 대상포진, 외상 등에 의한 통증성 삼차신경병증 그리고 SUNCT나 SUNA 등의 두통과의 감별을 고려해야 한다[24,45,57].
1) 삼차신경 영역 통증의 다른 원인
급성 대상포진, 대상포진 후 신경통, 삼차신경 외상 등이 삼차신경 영역에 신경통을 일으킬 수 있는데, ICHD-3 상 통증성 삼차신경병증으로 분류한다[2.56].
통증성 삼차신경병증 질환군으로는 통증성 삼차신경병증, 대상포진 후 통증성 삼차신경병증, 외상 후 통증성 삼차신경병증, 다른 질환에 기인한 통증성 삼차신경병증, 특발성 통증성 삼차신경병증 등이 있다[1,2]. 통증성 삼차신경병증에서는 삼차신경통과는 달리 통증이 주로 연속적이거나 거의 연속적이며 대부분 작열감이나 쥐어짜는 듯한 느낌 또는 핀과 바늘로 찌르는 듯한 양상이며, 짧은 통증 발작도 발생하기도 하나 흔하지는 않다[2,37,38].
대부분의 경우 통증성 삼차신경병증은 철저한 병력과 검사를 통해 구별할 수 있는데, 특히 V1 영역은 삼차신경통 환자의 5% 미만에서만 통증이 발생하는 부위이나[24], 대상포진후신경통의 경우 삼차신경 영역 중 가장 흔히 발생하는 부위가 V1 영역이다[2,38].
2) 치과질환에 의한 통증
삼차신경통은 때때로 치과적 질환에 의한 통증과 혼동될 수 있다[2,47,48]. 치과적 통증은 일반적으로 지속적이고 둔감하거나 욱신거리는 구강 내 통증인 반면, 고전적 삼차신경통은 간헐적이고 예리한 통증이다[2,47,48]. 고전적 삼차신경통은 종종 치아를 닦거나 씹는 것과 같은 동작에 의해 유발되기도 하여 치과 원인을 의심하고 치과를 먼저 방문하는 경우가 종종 있다[48]. 또한, 일부 환자에서는 치통과 유사한 비전형 증상(턱 또는 치아 통증)을 특징으로 하는 삼차신경통 전단계인 "전삼차신경통(pretrigeminal neuralgia)”을 앓기도 한다[2,38].
3) 두통 및 두개안면 통증의 기타 원인
결막 충혈 및 눈물 등의 자율신경계 증상이 두드러지게 나타날 때는 SUNCT나 SUNA과 같은 두통과 감별이 필요하다[56,57]. 안와, 눈주위 또는 측두부에 갑작스러운 짧은 발작 양상의 심한 편측성 두통이 동측 자율신경 증상과 함께 나오는 것이 특징이다[2,38,57,58]. 피부 접촉을 포함한 여러 요인에 의해 유발될 수 있다[2,38,57,58]. 짧고 찌르는 발작, 피부 접촉 유발, 삼차 V1 분지의 통증과 자율신경 증상의 특성이 나올 수 있는 SUNCT, SUNA 및 안구분지 삼차신경통은 그 구별이 어려울 수 있다[2,38,57,58]. SUNCT와 SUNA의 자율신경 증상 정도가 삼차신경통보다 훨씬 심하므로 서로 다르다는 의견이 많은 반면, SUNCT, SUNA 및 삼차신경통이 연속선 상에 존재하는 질환군이라는 일부 주장도 있다[57].
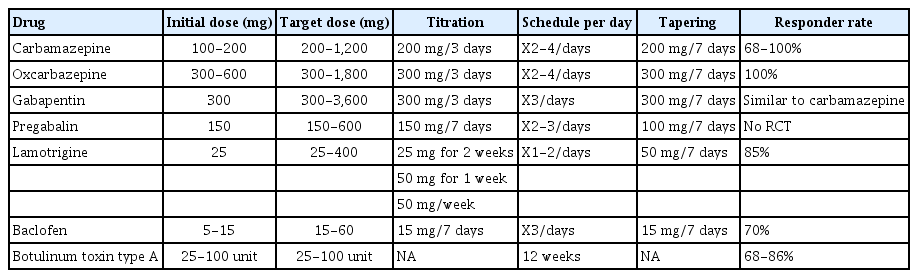
6. 약물 치료
카바마제핀(carbamazepine) 또는 옥스카바제핀(oxcarbazepine)을 사용한 약물요법은 대부분의 고전적 삼차신경통(신경혈관 압박에 의해 유발)과 특발성 삼차신경통에 대한 1차 초기 치료이다(Table 1) [2,38,49]. 수술은 내과적 치료에 반응하지 않는 환자에서 고려한다[2,38,49]. 이차성 삼차신경통에서는 약물 비교 연구가 부족하지만, 고전적 삼차신경통에서 사용되는 것과 동일한 약물을 사용하여 치료하도록 한다[49]. 치료 방법은 기저 원인에 맞추어 정하도록 한다[2,38,49].
1) 1차 약물요법
카바마제핀 또는 옥스카바제핀으로 초기요법을 권장한다[2,38,49].
(1) 카바마제핀(carbamazepine)
고전적 삼차신경통에 대해 가장 많이 연구된 치료법이며 효과적인 것으로 확립되었다[2,6,38,59]. 메스꺼움, 구토, 설사, 저나트륨혈증 등의 부작용은 문제가 될 수 있지만 일반적으로 관리할 수 있으며, 초기에 저용량을 처방하고 점진적 증량하여 적정 농도로 맞추는 경우 더 안정적으로 조절 가능하다[2,6,38,59-62].
① 효능
총 147명의 환자를 대상으로 한 4개의 무작위 대조 시험에서 삼차신경통에 대한 카바마제핀(매일 200-1,200 mg)의 효과가 확립되었다[59-62]. 미국과 유럽 신경과학회에서 2008년에 발표한 리뷰에서 위약에 비해(0-40%) 카바마제핀군의 58-100%에서 완전하거나 거의 완전한 통증 조절이 달성되는 치료 반응이 있음을 보고하였으나, 부작용으로 약물 유지가 어려운 경우가 종종 있음을 보고하였다[6,63].
② 투약
일반적 시작 용량은 100-200 mg 1일 2회로 충분한 통증 완화가 달성될 때까지 200 mg씩 몇 주에 걸쳐 점진적으로 증량할 수 있다. 일반적 총 유지 용량은 1일 600-800 mg이며, 최대 권장 총 용량은 하루 1,200 mg이다[2,38].
③ 부작용
메스꺼움, 구토, 설사, 저나트륨혈증, 발진, 가려움증, 졸음, 현기증, 시각 증상, 기면, 두통 등이 있다. 느리게 증량하면 이러한 부작용을 최소화할 수 있다[2,6,38,59]. 백혈구감소증은 드문 일이 아니지만 일반적으로 경과가 나쁘지 않다[2,6,38,59]. 드물지만 심각한 부작용으로는 무과립구증, 재생불량성 빈혈, 스티븐스-존슨 증후군, 독성 표피 괴사, 간부전, 약물 반응에 의한 호산구 증가증 및 전신 증상(drug reaction with eosinophilia and systemic symptoms), 피부염/발진, 혈청병, 췌장염, 루푸스 증후군 및 저감마글로불린혈증이 있다[2,6,38,59]. 치료를 시작하기 전에 유전적으로 위험이 있는 집단(즉, 동아시아 또는 남아시아 혈통을 가진 사람들)에서 HLA-B*15:02 대립유전자에 대한 검사를 할 수 있으며, HLA-B*15:02 대립유전자는 스티븐스-존슨 증후군 및/또는 독성 표피 괴사의 발생 위험 증가와 관련된 유전적 감수성 마커이다[2,6,38,59]. 유전자검사 결과 HLA-B*15:02 대립유전자가 존재하면 사용을 피해야 한다[2,6,38,59].
(2) 옥스카바제핀(oxcarbazepine)
삼차신경통에 효과적인 약물이며, 카바마제핀에 비해 내약성이 좋고 약물 상호작용이 적어 선호되는 약물이다[27,64,65].
① 효능
2008년 미국과 유럽학회의 진료지침에 의하면 환자 178명을 대상으로 옥스카바제핀(매일 600-1,800 mg)과 카바마제핀을 비교한 여러 무작위 통제 시험 결과 동등하게 효과적이었으며 두 치료 그룹의 환자 중 88% 이상 통증 발작을 50% 이상 감소시켰다[6].
2) 1차 요법의 대안 및 보조제(alternatives and adjuncts to first-line therapy)
카바마제핀 및 옥스카바제핀에 불내성 또는 금기인 삼차신경통 환자의 경우 라모트리진(lamotrigine), 가바펜틴(gabapentin) 또는 바클로펜(baclofen)을 사용한다[2,6,38,59,66-70]. 1차 치료 단독 요법에 반응하지 않는 일부 환자는 가바펜틴, 라모트리진, 토피라메이트(topiramate), 바클로펜 또는 티자니딘(tizanidine)과의 병용 요법이 도움이 될 수 있으나, 단일 요법과 병용 요법을 비교하는 무작위 대조 시험 연구는 없다[2,6,38,59,71-78]. 일부 전문가들은 삼차신경통에 대한 대체 약물의 반응 효과 가능성이 낮다고 주장하며, 1차 요법에 반응하지 않는 모든 환자에 대해 조기 수술 의뢰를 권고하기도 한다[27,71].
내약성이 없거나 1차 치료에 반응하지 않는 삼차신경통 환자에 대한 치료 대안을 뒷받침하는 증거는 제한적이다[2,6,38,59]. 2008년 미국과 유럽학회의 치료방침은 바클로펜, 라모트리진 및 피모자이드(pimozide)가 효과적일 가능성이 있다고 결론지었다[6,71,72]. 보툴리눔 독소 주사를 효과에 대한 데이터도 있다[2,6,38,59,73]. 유럽신경학회의 후속 체계적 검토에서는 1차 제제가 효과 또는 내약성이 낮을 경우, 라모트리진, 가바펜틴, 보툴리눔 독소 A형, 프레가발린, 바클로펜(하루 40-80 mg) 및 페니토인을 단독 요법으로 사용하거나 1차 요법과 함께 보조제로 사용할 수 있다고 결론지었으나 그 근거가 미약하여 추후 연구가 필요하다[49,74].
7. 약물 난치성 환자에 대한 수술 치료
내과적 치료에 반응하지 않는 삼차신경통 환자의 경우 미세혈관감압술(microvascular decompression), 뿌리절개술(rhizotomy) 또는 감마나이프 방사선수술(gamma knife radiosurgery) 을 이용한 수술적 치료 옵션을 논의한다[2,87]. 수술 결정 및 수술 옵션 선택은 환자 선호도, 시술의 부작용, 센터의 전문성 등 개별 상황에 따라 영향을 받는다[2,38].
1) 고전적 삼차신경통
영상으로 확인된 신경혈관 압박이 있고 대수술을 견딜 수 있는 환자의 경우 다른 수술보다는 미세혈관 감압술을 제안한다[2,38,87]. 수술 대상자가 부적절하거나 개두술을 기피하는 환자의 경우 경피적 신경절 시술이나 감마나이프 정위 방사선수술이 대안이 될 수 있다[87-90].
결 론
삼차신경통은 진단과 치료가 어려운 치명적 질환이다. 아직까지 삼차신경통에 대한 약물 요법의 근거 마련을 위한 더 많은 연구가 필요한 실정이지만, 최근 몇 년 동안 새로운 약물의 발견과 영상의 발전, 혁신적 수술법 등으로 삼차신경통 치료 방법의 많은 발전이 있었다. 삼차신경통의 진단 및 다양한 치료법의 최신 지견을 통해 삼차신경통의 심각한 고통을 적절히 경감시켜 질환의 예후를 충분히 향상시킬 수 있음을 인식해야 한다.