전기적근긴장증을 동반한 Dynamin 2유전자변이 중심핵근병증
Dynamin 2-Related Centronuclear Myopathy with Electrical Myotonia
Article information
임상적으로 수의수축 이후에 근육의 이완이 지연되는 증상을 근긴장증(myotonia)이라고 표현하고 근긴장증이 있으면 침근전도검사를 통하여 근긴장방전이 보이는지 확인한다. 근긴장증은 특정 근육질환에서 관찰되기 때문에 근육질환의 감별진단에 도움이 되고, 침근전도검사에서 근긴장전위가 보이면 근긴장디스트로피(myotonic dystrophy)와 비디스트로피근긴장증을 우선 고려해야 한다. 중심핵근육병증(centronuclear myopathy)은 드문 선천성 근육병증으로 전기진단검사에서 자발전위가 없고 근육병에 합당한 운동단위 활동전위가 보인다. 저자들은 침근전도검사에서 뚜렷한 근긴장방전을 보인 중심핵근육병증 1예를 보고하고자 한다.
증 례
30세 남자가 10대 중반에 발생한 다리의 근력저하로 내원하였다. 증상은 서서히 진행하여 계단오르기가 힘들어지고 팔에도 근력저하가 발생하였다. 감각 증상, 발음이상, 근위축은 동반되지 않았다. 과거력과 사회력에서 특이 사항이 없고 복용 중인 약물도 없었다. 가족력에서 외할머니, 어머니, 이모, 이종사촌에서 비슷한 근력저하가 있었다.
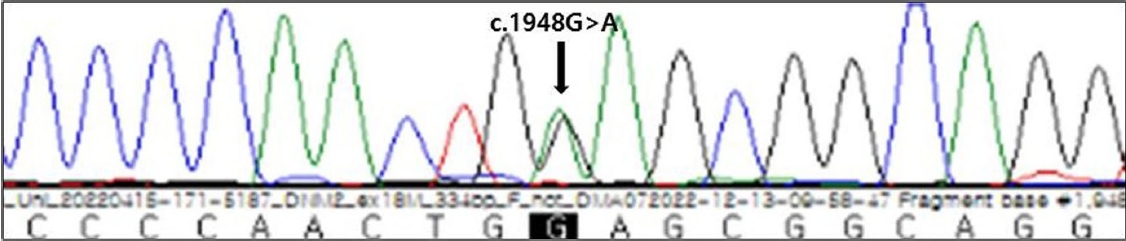
신체진찰에서 이마탈모가 보였고. 신경계진찰에서 의식은 명료하였고 뇌신경기능은 경한 안검하수가 양쪽에서 보이는 것을 제외하고는 정상이었다. 근력은 양쪽 하지 근위부가 Medical Research Council 등급 4+이고, 나머지는 정상이었으며 근위축이나 근비대 소견은 없었다. 감각검사와 깊은힘줄반사에서 정상이었고 바뱅스키(babinski) 징후도 보이지 않았다. 근육의 이완 지연이나 타진근긴장증도 보이지 않았다. 혈액검사에서 크레아틴키나제가 552 IU/L (참고치 <272 IU/L)로 약간 증가하였고 전체혈구계산검사, 전해질검사, 생화학검사, 갑상선기능검사, 적혈구침강속도, 종양표지자 및 자가면역질환 관련 인자들은 정상이었다. 신경전도검사는 정상이었고, 근전도 검사에서 근육병을 시사하는 운동단위활성전위가 보이고 뚜렷한 전기적 근긴장증이 보였다(Fig. 1). 차세대염기서열분석(next generation sequencing, NGS) 유전자검사에서 dynamin 2 (DNM2)의 유전자변이(c.1948G>A; p.Glu650Lys)가 관찰되었다(Fig. 2). 근긴장근디스트로피와 고칼륨주기성마비, 폼페병에 대한 dystrophia myotonica protein kinase (DMPK), sodium voltage gated channel alpha subunit 4 (SCNA4), alpha glucosidase (GAA) 유전자는 음성으로 나왔다. 증례의 환자는 상염색체 우성 유전, 근육병 증상과 근전도 결과, 유전자 검사를 토대로 DNM2유전자변이 중심핵근병증으로 진단하였다.
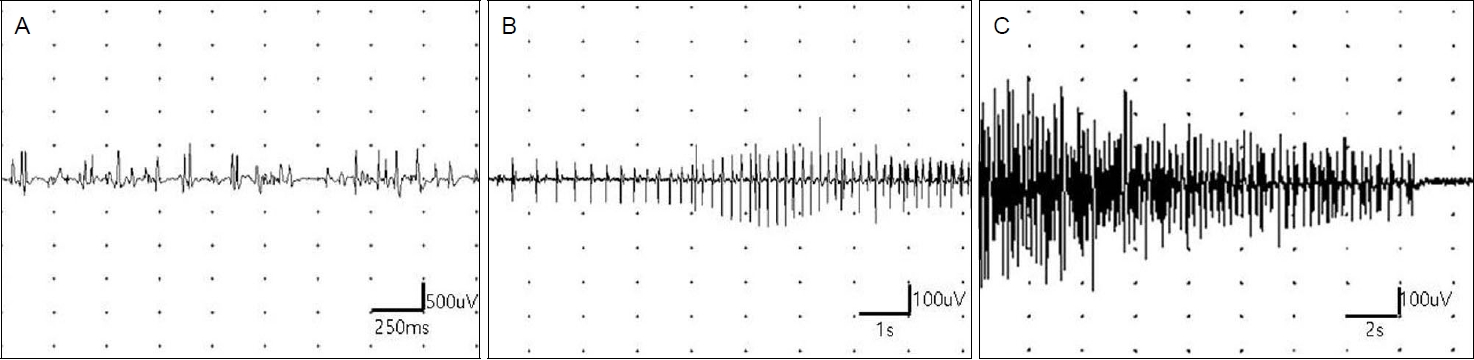
Electromyography findings. (A) Small-amplitude, polyphasic motor unit action potentials fire with a small amount of force. (B, C) Myotonic discharges are recorded in the first dorsal interosseous and tibialis anterior muscles.
고 찰
중심핵근육병증은 드문 유전성 근육질환으로 조직학적으로 근섬유 중앙에 위치한 핵과 1형 근섬유의 위축이나 우위가 특징이다[1-3]. 유전 양상에 따라 X연관 열성형, 보통염색체 우성형, 보통염색체 열성형으로 나누고, 중증도나 예후도 유전 양상과 관련이 깊다. X연관 열성형은 출생 시부터 근긴장도저하, 안구운동장애, 호흡부전을 보이고, 대부분 생후 1년 내에 사망하는 가장 나쁜 예후를 보인다. 보통염색체 열성형은 대부분 영유아기에 발병하여 서서히 진행한다. 보통염색체 우성형은 대부분 청소년기나 성인기에 발병하고 경한 근위부 근력저하, 안검하수, 안구운동장애를 보인다. 혈액검사에서 크레아틴키나제는 정상이거나 약간 증가되어 있다. 국내에서 보고된 DNM2유전자변이 중심핵근병증 환자는 모두 소아청소년기에 사지의 근력저하가 발생하였고, 안구운동장애가 75%에서 동반되었고, 안검하수, 안면마비, 아킬레스건 구축증, 척추전만은 50%에서 동반되었다[4]. 증례의 환자도 청소년기에 근력저하가 발생하였고 안검하수가 동반되었으나 나머지 증상들은 관찰되지 않았다.
전통적으로 조직검사로 중심핵근육병증을 진단하였지만, 중심핵은 근긴장디스트로피, 다양한 근육병증, 만성 신경병증, 재생 근섬유에서도 관찰된다[5]. 반면에, 증상이 경한 중심핵근육병증에서는 중심핵이 관찰되지 않는 경우도 있고 조직검사를 시행한 근육에 따라서 중심핵의 빈도가 달라진다[6]. X연관 열성형은 X염색체 장완(Xq28)에 위치한 myotubularin (MTM1) 유전자, 보통염색체 열성형은 2번염색체 장완(2q14)에 위치한 amphiphysin 2 (BIN1) 유전자와 19번염색체 장완(19q13.2)에 위치한 ryanodine receptor (RYR1)유전자, 보통염색체 우성형은 19번염색체 단완(19p13.2)에 위치한 DNM2유전자변이로 인해 발생한다[1,3]. 최근에 NGS나 전체유전자분석(whole genome sequencing)이 대부분의 병원에서 가능해지면서 유전자검사가 조직검사의 부족한 점을 보완 또는 대체하고 있다. 근육조직검사 전에 유전자 검사를 시행하여 유전성 근육질환을 유발하는 것으로 알려진 유전자변이가 확인되면 추가적인 조직검사를 시행하지 않기도 한다[2].
침근전도검사에서 근긴장전위가 보이는 대표적인 질환은 근긴장디스트로피와 비디스트로피근긴장증이고 이외에 고칼륨주기성마비, 다발근육염, 갑상선기능저하증, 폼페병에서도 가능하다[7]. 감별진단을 위해서는 임상적 근긴장증의 유무가 중요하며, 근긴장디스트로피와 비스트로피근긴장증, 고칼륨주기성마비에서는 임상적 근긴장증이 동반된다. 근긴장디스트로피는 진행하는 근력저하와 다양한 전신 증상이 있다는 점에서 비디스트로피근긴장증, 고칼륨주기성 마비와 감별할 수 있다. 증례의 환자는 전기적 근긴장증이 뚜렷하여 임상적 근긴장증이 있는지 여러 차례 확인하였으나 이완지연이나 타진근긴장증은 보이지 않았다. 근긴장전위가 관찰되는 질환 중에서 폼페병은 임상적으로 근긴장증 소견이 보이지 않고 침근전도검사에서만 근긴장전위가 보인다. 증례의 환자는 근긴장디스트로피의 DMPK유전자검사가 음성이었다. 고칼륨주기성마비와 선천이상근기장증(paramyotnia congenita)의 SCN4A를 포함한 유전성 근육병증에 대한 NGS에서 DMN2유전자변이가 관찰되었고 나머지는 모두 음성이었다. 보통염색체 열성유전인 폼페병과 유전 양상이 맞지 않으나 근긴장증 증상 없이 근긴장전위만 보여서 폼페병에 대한 유전자검사도 시행하였고 결과는 음성이었다.
DNM2는 GTP결합가수분해효소(GTPase) 단백질을 발현하는 유전자로 액틴세포골격(actin cytoskeleton) 조립과 중심체(centrosome) 결합에 관여한다[3]. 또한, DNM2유전자변이 환자의 세포에서 클라트린(clathrin) 매개 세포내 이동의 저하를 관찰하였고, 이는 막이동(membrane trafficking)의 이상이 병태생리에 관여함을 시사한다[8]. DNM2유전자변이에 의한 유전성 신경근육질환은 아주 드물지만, 중심핵근병증을 유발하는 유전자변이 중에서는 약 50%를 차지하는 가장 흔한 유전자이다. 중심핵근병증에서 근긴장전위가 관찰된 증례가 드물게 보고되었고, 모두 DNM2유전자변이와 관련되어 있었다[9,10]. 또한, 본 증례와 마찬가지로 모든 증례에서 근전도검사에서만 근긴장전위가 보이고 근긴장증의 임상 증상은 보이지 않았다.
본 증례의 환자와 이전에 보고된 문헌은 근긴장전위가 DNM2유전자변이 중심핵근병증에서 관찰될 수 있는 근전도 소견임을 보여준다. 유전성 근육병이 의심되는 환자에서 전기적 근긴장증이 보이면 중심핵근병증도 감별진단에 고려해야 한다.