 |
 |
- Search
| Korean J Neuromuscul Disord > Volume 14(1); 2022 > Article |
|
ABSTRACT
Muscle and nerve biopsy may be vital diagnostic tools in various neuromuscular disorders. Since these procedures are invasive, it matters to decide when to perform a biopsy, which muscle or nerve to be selected, and how to interpret the pathologies. This review addresses the indications, methods of biopsies, and also significant pathological findings frequently encountered in muscle and nerve pathology.
신경근육질환의 조직 소견을 관찰하기 위해 임상에서 종종 근생검과 신경생검을 계획하게 된다. 근생검과 신경생검은 침습적이지만 비교적 조직을 획득하는 방법이 용이하며, 적절하게 얻은 조직 소견은 원인을 감별하거나 치료의 방향을 제시하는 데 중요한 정보를 제공할 수 있다. 그러나, 충분한 임상평가가 이루어지지 않아 올바른 임상추론에 도달하지 못하였거나 생검 부위를 잘못 선택하거나 혹은 생검 후 조직 소견을 제대로 판독하지 못한다면 환자에게 불편감만 초래하고 아무런 정보를 얻지 못할 수도 있다. 따라서, 근생검 또는 신경생검에 앞서 임상평가를 충분히 시행하고 관찰되는 조직 소견을 통해 적절한 정보를 얻을 수 있도록 해야 할 것이다. 본고에서는 근생검과 신경생검을 결정해야 하는 임상 상황과 생검의 술기 그리고 조직 소견을 해석하는 방법에 대해 기술하고자 한다.
기본적으로 근육병이 의심되는 경우에 근생검의 시행 여부를 고민하게 된다. 근육병이 의심되는 상황이란 환자가 감각이상을 동반하지 않는 근력 저하를 호소하는 경우인데, 사지의 근력뿐만 아니라 안면부 위약과 구마비를 포함할 수도 있다. 많은 근육병에서는 혈청 크레아틴인산화효소가 상승하므로 근거가 될 수 있으나 그렇지 않은 경우 또한 많으므로 감별에 유의해야 한다. 침근전도검사 또한 근육병의 유무를 판별하는 데 매우 중요하다. 운동단위전위(motor unit potential)의 크기가 작고 지속 시간이 짧으며 동원속도가 빠른 경우(rapid recruitment) 근육병을 의심할 수 있다. 그러나 침근전도검사 역시 근육병 소견을 뚜렷하게 보이지 않는 경우가 있다. 따라서 단순히 근육병의 유무를 위와 같은 요소에만 의존하여 판단해서는 안 되며 발병 양상, 진행 경과, 근육침범의 범위, 가족력의 유무와 동반질환의 유무 등과 같은 정보를 함께 수집함으로써 가능한 한 근접한 임상진단에 도달할 필요가 있다. 이를 바탕으로 예상되는 조직 소견을 미리 염두에 두고 근생검을 계획하는 것이 진단에 도움이 될 것이다.
최근 분자유전학의 발전으로 한 번에 많은 유전자를 검색할 수 있게 되면서 유전성 근육병의 진단에 근생검이 생략되는 경우가 많아졌다. 특히 매우 특징적인 임상 증상을 보이는 얼굴어깨위팔근디스트로피(facioscapulohumeral dystrophy) 와 근긴장근디스트로피(myotonic dystrophy)같은 경우가 대표적이다. 이 경우 임상 소견에 근거하여 유전자검사를 바로 시행하게 된다. 이 외에도 가족력이 분명하고 가족의 유전자검사가 용이하게 이루어질 수 있는 경우에도 근생검을 생략할 수 있다. 그러나 염증근육병과 조직 소견이 특징적인 선천근육병(congenital myopathies)에서는 여전히 근생검을 통한 진단이 매우 중요하며 분자유전학검사를 통해 얻은 광범위한 유전정보를 감별하는 데에도 근육의 조직 소견이 도움이 되는 경우가 많이 있다. 근육병이 의심되고 그 원인을 진단하기 위해 근육조직의 관찰이 필요한 상황인지를 적절하게 판단하는 것이 무엇보다 중요하다.
근생검을 결정하였다면 어떤 근육에서 생검을 할 것인가가 다음으로 중요한 선택이 될 것이다. 근생검은 비교적 용적이 큰 근육에서 시행하며, 거의 침범되지 않거나 너무 심하게 침범된 근육은 피하는 것이 좋으므로 이를 판단하기 위해 침근전도검사와 근육 영상검사의 결과를 참고하는 것이 좋다. 한편, 침근전도검사를 시행한 근육은 피하는 것이 좋은데 이는 침의 삽입을 통해 발생한 이차 변화가 판단에 혼돈을 줄 수 있기 때문이다. 모든 요건을 만족한다면 위팔두갈래근(biceps brachii)을 선택하는 것이 가장 좋은데 이 근육은 피하지방층이 적어 접근이 용이하며, 근섬유의 배열이 평행하고 근섬유 유형의 분포가 잘 알려져 있으므로 비정상 소견을 판단하기 쉽기 때문이다. 또한, 체중부하가 적은 부위이므로 생검 이후의 상처 치유에도 유리하다.
근생검은 생검 부위의 국소마취 후에 시작하며 생검하고자 하는 근육의 부위에 피부절개를 하고 근막을 박리한 후 일부 근육다발(fascicle)을 분리하여 잘라내면 된다. 생검한 조직은 코르크 판 위에 수지(gum)를 이용하여 고정하고 이를 액화질소에 중탕한 이소펜탄에 넣어 약 1분간 흔들어서 급속 냉각시킨다. 이후 저온유지장치(cryostat)에서 -20℃를 유지한 상태로 슬라이드 절편을 만든다[1].
전체 골격근은 근육외막(epimysium)에 둘러싸여 있고 하나의 근육은 여러 개의 근육다발(fascicle)로 이루어져 있다. 근육다발은 근육다발막(perimysium)에 싸여 있으며 다수의 근섬유(muscle fiber)로 이루어진다. 개별 근섬유는 근육내막(endomysium)으로 구분되며 이는 다시 다수의 근원섬유(myofibril)로 구성된다. 광학현미경에서는 개별 근섬유까지 관찰할 수 있으며 염색을 통해 근원섬유의 망조직(network)을 간접적으로 관찰할 수 있다. 근원섬유의 세부 조직을 파악하기 위해서는 추가적으로 전자현미경을 통해 관찰해야 한다.
근육조직을 관찰하기 위한 염색법은 크게 조직염색, 조직화학염색과 면역조직화학염색으로 나눌 수 있다[1]. 조직염색에는 헤마톡실린-에오신(hematoxylin-eosin, H&E)염색과 고모리-트라이크롬(Gomori-trichrome)염색이 있다(Fig. 1A, B). 이 두 가지 염색은 근섬유의 전반적인 구조를 잘 보여주며, 이 외에 염증세포의 유무, 혈관, 근육방추(muscle spindle) 및 근육내신경(intramuscular nerve)도 관찰할 수 있다. 조직화학염색 중 니코틴아마이드 탈수소효소-테트라졸륨 환원효소(nicotinamide dehydrogenase-tetrazolium reductase, NADH-TR) 염색은 근원섬유사이망구조(intermyofibrillar network)를 염색함으로써 근원섬유의 배열 상태를 간접적으로 평가할 수 있다(Fig. 1C). 석신산 탈수소효소(succinate dehydrogenase, SDH)와 사이토크롬 C 산화효소(cytochrome C oxidase, COX)는 사립체 효소로써 사립체근육병을 진단하기에 유용한 염색이다(Fig. 1D). 이 외에 삼인산아데노신 분해효소(adenosine triphosphatase, ATPase)는 pH에 따라 1형과 2형 근섬유를 구분되게 염색하여 근섬유형 분포를 파악할 수 있다(Fig. 1E). ATPase 염색의 알칼리 pH에서는 2형 근섬유가 어둡게, 1형 근섬유가 밝게 염색되며 산성 pH에서는 1형 근섬유가 어둡게, 2형 근섬유가 밝게 염색된다.
산성인산염분해효소(acid phosphatase) 염색은 용해소체(lysosome) 효소로써 대식세포의 활성을 반영하며, 과아이오드산시프(periodic acid Schiff, PAS) 염색과 oil-red O(ORO) 염색은 각각 당원과 지방에 반응하여 염색되므로 당원축적병(glycogen storage disease)과 지질축적병(lipid storage disease)을 진단할 수 있는 유용한 염색이다.
면역조직화학염색은 특정 단백항원에 대한 항체를 이용하여 염색하는 방법으로 근조직 내에 해당 단백질의 유무 혹은 양적변화를 확인하는 데 도움이 된다. 염증근육병에서 주조직적합복합체(major histocompatibility complex, MHC)와 막공격복합체(membrane attack complex, MAC) 등을 표적으로 하여 염색하며, 다양한 근디스트로피의 원인이 되는, 근섬유막에 존재하는 단백질의 결핍 또는 소실을 파악하기 위한 목적으로 사용한다[2].
정상 골격근에서 근섬유는 성인에서 40-80 μm의 크기의 다각형 모양이며, 인접한 근섬유 사이에는 결합조직이 채우고 있으나 매우 적은 양이므로 거의 구별되지 않는다(Fig. 1A, B). 핵은 하나의 근섬유 내에 여러 개 존재하나 모두 근섬유의 가장자리에 위치하며 정상에서도 1% 미만의 근섬유에서는 세포질 내에 위치한 내핵(internal nuclei)을 관찰할 수 있다[3]. NADH-TR 염색을 통해 관찰되는 근원섬유사이망조직은 균질하며 COX 염색에서 모든 근섬유가 적절하게 염색이 되고(Fig. 1C, D) ATPase 염색에서는 1형과 2형의 근섬유가 무작위로 배열된 바둑판 모양을 보인다(Fig. 1E). 대부분의 염색에서 정상 근섬유의 세포질은 균일하게 염색되며, 세포질 내에 다른 구조물은 관찰되지 않는다.
근육병에 이환된 근육은 위축근섬유(atrophic fiber)가 많아지면서 근섬유 크기의 폭이 증가하고 근섬유 모양이 둥글게 변하며 인접한 근섬유 사이의 공간이 증가하면서 섬유조직으로 채워진다(Fig. 2A) [4]. 또한 내핵을 가진 근섬유의 빈도가 증가하게 된다. 이러한 변화는 근육병의 종류에 관계없이 공통적으로 관찰되는 소견으로 근육병의 유무를 판단할 수 있지만 감별 진단에는 도움이 되지 않는다는 점에 유의해야 한다.
듀셴/베커 근디스트로피(Duchenne/Becker muscular dystrophy) 나 사지대근디스트로피(limb-girdle muscular dystrophies), 선천근디스트로피(congenital muscular dystrophies)와 같은 다양한 근디스트로피의 경우 매우 만성적인 진행 경과를 보이는 질환이므로 위축근섬유 뿐만 아니라 비대근 섬유(hypertrophic fiber)가 자주 관찰되고 따라서 근섬유 크기의 폭이 현저하게 증가하며 내핵의 빈도와 근섬유 사이 섬유질 증식 또한 현저하게 관찰된다(Fig. 2B). 지방세포가 근섬유를 대체하는 현상도 만성 근육병을 시사하는 소견이다[4,5]. 근디스트로피에서는 또한 괴사섬유(necrotic fiber)와 재생섬유(regenerating fiber)가 중요한 소견이다(Fig. 2C, D). 괴사섬유는 세포질이 옅어지며 종종 대식세포에 의해 탐식되는 모습으로 관찰되기도 한다[5]. 재생섬유는 세포질이 호염기성을 띄며 핵의 크기가 크고 핵의 내부에서 핵인(nucleoli)이 관찰되기도 한다[5]. 중요한 것은 이러한 변화들 역시 대부분의 근디스트로피에서 공통적으로 관찰되는 비특이적인 소견이라는 것이다. 근디스트로피의 감별진단을 위해서는 추가적인 면역조직화학염색과 유전자검사가 필수적이며, 이에 앞서 충분한 임상평가가 선행되어야 한다.
조직에서 염증반응을 볼 수 있는 대표적인 질환은 염증근육병이다. 간혹 사대지근디스트로피 R2형과 얼굴어깨위 팔디스트로피에서 염증반응이 나타날 수 있어 진단에 주의를 요한다. 조직 소견에서는 공통되는 근육병 소견과 괴사 및 재생섬유를 관찰할 수 있으며 이에 더해 염증세포의 침윤이 근육내막, 근육다발막 또는 혈관 주위에서 다양하게 관찰될 수 있다(Fig. 2E, F)[6]. 염증세포의 침윤이 심한 곳에서는 대식세포의 활성이 증가하고 따라서 용해소체 효소의 양이 증가하므로 산성인산염분해효소 염색에서 높은 활성이 나타난다[6]. 이는 염증근육병에서 공통적으로 관찰할 수 있는 소견이지만 특히 면역매개괴사근육병(immune-mediated necrotizing myopathy)에서 더욱 두드러지는 것으로 알려져 있다[7]. 봉입체근염(inclusion body myositis)이나 다발근염(polymyositis)에서는 주로 근육내막에 염증세포가 침윤되며 특징적으로 염증세포가 비괴사섬유의 주변을 둘러싸거나 비괴사섬유 내부로 침투해 가는 모습을 관찰할 수 있다(Fig. 2F). 봉입체근염에서는 고모리-트라이크롬에서 테두리공포(rimmed vacuoles)가 관찰되는 것이 특징이기도 하지만(Fig. 3A) 이러한 염증세포 침윤 양상은 진단에 중요한 근거가 된다[7].
앞서 기술한 바와 같이, 정상 근섬유의 세포질은 대부분의 염색에서 매우 균질하게 염색되며 눈에 띄는 구조물을 포함하지 않는다. 따라서, 근섬유 내에 비정상 염색 양상을 보이거나 비정상 구조물이 관찰된다면 이는 근육병을 시사한다. 이러한 소견이 관찰되는 대표적인 질환이 선천근육병(congenital myopathies)이며 이들은 선천근육병의 감별진단에 중요한 단서가 된다.
중심핵심(central core)은 NADH-TR이나 COX 염색에서 가장 구별되는데, 세포질 내에 염색이 결핍된 둥근 모양의 영역을 의미한다(Fig. 3C). 중심핵심이 대다수의 근섬유에서 관찰된다면 보통 중심핵심병(central core disease)을 진단할 수 있으며 이와 관련된 유전자를 검색함으로써 최종진단에 이를 수 있다[8,9].
여러 개의 핵이 가장자리에 위치하는 정상 근섬유와 달리 대다수의 근섬유에서 단일 핵이 근섬유 중앙에 위치하는 경우 이들을 중심핵(central nuclei)이라고 하며 중심핵근육병(centronucelar myopathy) 또는 근소관근육병(myotubular myopathy)을 예상할 수 있다(Fig. 3D). 중심핵은 이들 두 질환의 공통된 소견이나 임상적으로 구별되는 질환이므로 선행된 임상평가를 통해 충분히 감별할 수 있다[10,11]. 뿐만 아니라, 두 질환은 NADH-TR 염색에서 보이는 소견이 서로 상이하므로 이 또한 감별에 도움이 된다. 즉, 중심핵근육병은 NADH-TR 염색에서 세포질가닥(sarcoplasmic strand)이 방사형으로 분포하는 모습을 보이는 반면, 근소관근육병은 ‘주변테(peripheral halo)’ 소견을 보인다. 각각은 서로 다른 원인 유전자가 알려져 있으므로 임상 소견과 병리 소견을 충분히 파악하여 적절한 유전자검사를 시행하는 것이 중요할 것이다.
고모리-트라이크롬 염색에서 붉게 염색되는 소체가 개별적으로 또는 뭉쳐져서 관찰되는 것을 네말린체(nemaline body)라고 한다(Fig. 3E). 네말린체는 다른 질환에서도 관찰될 수 있으나 가장 특징적인 질환이 네말린근육병(nemaline myopathy)이다[8].
근섬유 구조의 변화가 나타나는 또 다른 질환은 근원섬유근육병(myofibrillar myopathy)이다. 근원섬유근육병에서는 근원섬유의 망구조가 파괴되며 세포질체(cytoplasmic body), 구형체(spheroid body), 테두리공포 등과 같은 다양한 비정상 구조물이 관찰되는 것을 특징으로 한다(Fig. 3F, G) [12]. 근원섬유근육병은 다양한 원인 유전자가 알려져 있는, 유전적으로 이질적인 질환이지만 이와 같은 병리 소견은 공통적으로 나타나므로 병리 소견만으로는 감별진단이 불가능하다는 점에 유의해야 한다.
테두리공포 또한 위에서 언급된 근원섬유근육병 외에 다양한 질환에서 관찰할 수 있다. 고모리-트라이크롬 염색에서 붉은 색의 테두리가 있고 속이 비어 있는 형태로 나타나며 가장 대표적으로 봉입체근염과 GNE근육병에서 관찰할 수 있다(Fig. 3A). 봉입체근염은 근육내막의 염증세포 침윤이 함께 관찰되며 임상적으로는 손가락굽힘근과 대퇴사두근의 위약이 특징적이다[7]. 한편, GNE근육병은 GNE 유전자의 돌연변이에 의해 발병하는 상염색체열성질환으로 특징적인 병리 소견에 근거하여 이전에는 ‘테두리공포를 동반한 원위근육병(distal myopathy with rimmed vacuoles)’으로 불리기도 하였다. 봉입체근염과 달리 질환이 많이 진행한 이후에도 대퇴사두근이 상대적으로 보존되며 가장 먼저 앞정강근(tibialis anterior)이 침범되어 발처짐(foot drop)이 초기에 나타나는 것이 특징이다[13]. 이외에도 매우 드문 질환이지만 눈인두근디스트로피(oculopharyngeal muscular dystrophy)와 눈인두원위근육병(oculopharyngeal distal myopathy)에서도 테두리공포를 관찰할 수 있다 [14,15].
당원이나 지질대사의 장애로 인해 근육병이 발생할 수 있다. 염색 방법 중 PAS 염색을 통해 근섬유 내 당원의 축적을 확인함으로써 당원축적병을 진단할 수 있으며(Fig. 4D), ORO 염색에서는 붉게 염색되는 지방방울(lipid droplet)을 확인함으로써 지질축적병을 진단할 수 있다(Fig. 4E). 대표적인 당원축적병이 폼페병이며 이는 용해소체 내에 존재하는 산성알파포도당화물분해효소(acid alpha glucosidase)의 결핍에 의해 발생하며 최근 효소대체요법을 통해 치료가 가능한 질환이므로 근육병을 진단할 때 염두에 두어야 한다[17]. 대표적인 지질축적병은 중성지질축적병(neutral lipid storage disease)이며 지방트라이글리세라이드지방분해효소(adipose triglyceride lipase, ATGL)의 결핍에 의해 발생한다[16].
신경생검은 근생검에 비해 조직 소견을 통해 얻을 수 있는 정보가 많지 않다. 생검의 대상이 되는 신경 역시 그 범위가 좁은 편이다. 따라서, 신경생검 역시 필요한 임상 상황을 잘 판단하여 적절한 정보를 얻을 수 있도록 하는 것이 무엇보다 중요하다.
신경생검은 혈관염이 의심되거나 원인을 모르는 말초신경병증이 있을 때, 조직 소견에 의해 치료가 달라질 수 있을 때 고려하게 된다. 혈관염 외에 아밀로이드나 사르코이드신경병에서도 신경생검이 중요한 단서를 제공할 수 있다. 당뇨나 알코올, 약물과 같은 잘 알려진 원인이 있는 경우에는 신경생검을 하지 않는다. 신경생검을 결정할 때 가장 도움이 되는 검사는 신경전도검사이다. 신경전도검사에서 침범이 확인되었을 때 생검에 가장 적합한 신경은 장딴지신경(sural nerve)이다. 장딴지신경은 혈관염이 있을 때 가장 잘 침범되는 신경이며 해부학적으로 생검이 용이하고 순수 감각신경이므로 생검 이후 신경결손을 최소화할 수 있기 때문이다. 생검 후에는 생검 부위의 감각저하를 피할 수 없는데 심한 경우 광범위한 부위의 감각저하가 발생하기도 하고 드물지만 해당 부위에 신경통이 동반되기도 한다.
장딴지신경은 바깥복사뼈(lateral malleolus)의 뒤쪽으로 주행하므로 바깥복사뼈의 뒤쪽 경계와 아킬레스건의 중간 지점에서 피부를 절개한다. 신경은 피부 바로 아래에 위치하므로 유의해야 하며 혈관이 함께 주행하므로 이를 구별하는 데도 유의해야 한다. 주변 조직으로부터 신경을 분리하여 약 2 cm 정도 잘라낸 후 피부를 봉합한다[19].
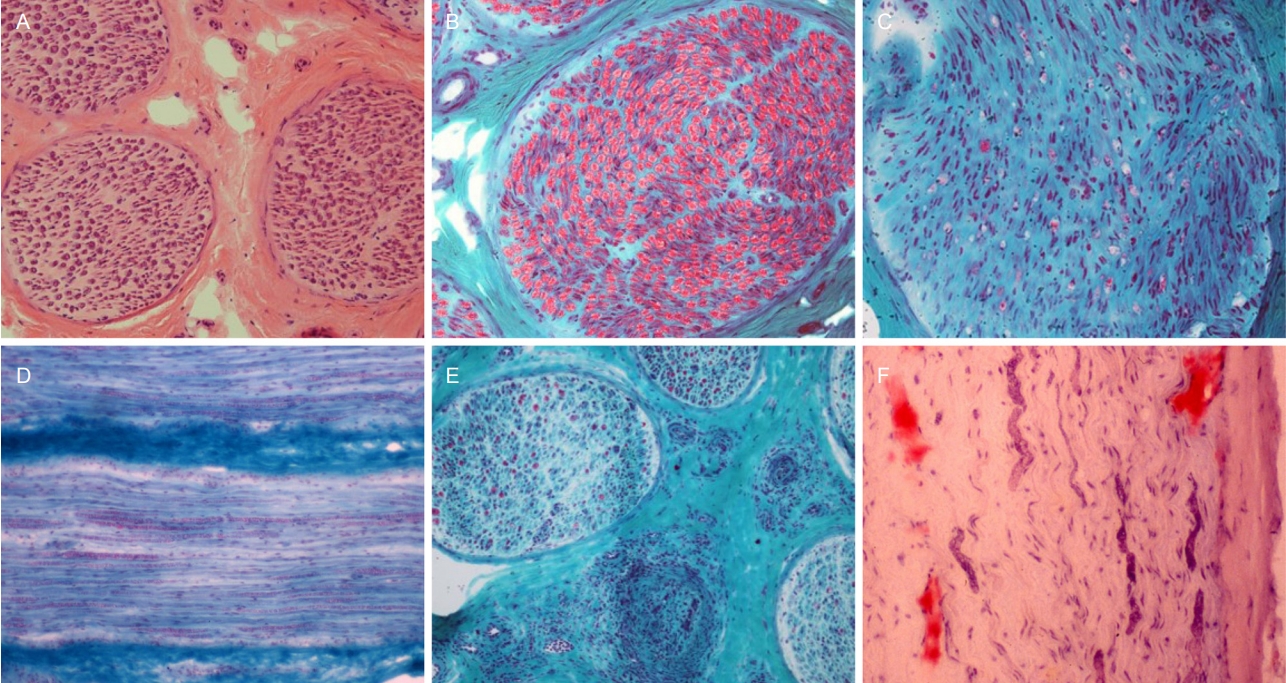
전체 신경은 신경외막(epineurium)이 둘러싸고 있으며 내부에는 5-15개 정도의 신경다발로 구성된다. 신경외막 공간(epineurial space)에는 신경다발 뿐만 아니라 작은 크기의 혈관을 포함하고 있어 혈관염의 유무를 판단하기 위해 이들을 관찰할 필요가 있다. 각각의 신경다발은 신경다발막(perineurium)으로 둘러싸이며, 수천-수만 개의 신경섬유(nerve fiber)를 포함하고 있다. 개별 신경섬유는 슈반세포와 신경축삭으로 구성되며 이들은 신경내막(endoneurium)에 의해 둘러싸인다[20].
신경조직의 염색은 근육조직과 유사하게 H&E 염색과 고모리-트라이크롬 염색을 하며 이 외에 아밀로이드를 관찰하기 위해 congo red 염색을 하기도 한다. 광학현미경 관찰을 위한 조직절편보다 훨씬 얇은 약 0.5 μm 두께의 semithin 절편을 만들어 톨루이딘블루(toluidine blue)염색을 하기도 하며 이때 개별 신경섬유의 수초와 축삭을 좀 더 자세하게 관찰할 수 있다.
축삭변성이 일어난 신경조직에서는 먼저 수초화된 신경섬유의 밀도가 현저하게 감소된 소견을 볼 수 있다. 뿐만아니라 수초가 파괴되어 나타나는 수초소화방(myelin-digestion chamber)이나 수초타원(myelin-ovoid)과 같은 소견이 흔히 관찰되며 작은 축삭들이 무리지어 관찰되기도 한다(Fig. 6C). 그러나, 이는 질환에 특이적인 소견은 아니며 축삭변성을 수반하는 대부분의 신경병에서 관찰할 수 있다[21].
보다 특이적인 축삭변성의 근거로는 거대축삭(giant axon) 이 있다. 광학현미경 관찰에서 일반적인 신경섬유의 수초와 축삭이 구별되어 확인되지는 않지만 거대축삭은 축삭의 지름이 현저하게 증가하므로 이를 구분하여 관찰할 수 있다. 거대축삭은 주로 본드나 시너를 흡입하는 등의 원인으로 독성신경병이 발생할 때 관찰할 수 있는 현상이다[21].
탈수초화 된 신경조직에서는 수초가 매우 가늘어진 소견을 볼 수 있는데, 이는 세로단면에서 구별이 더 용이하다(Fig. 6D). Semithin 절편에서도 수초가 얇아진 현상을 관찰할 수 있다. 이 역시 질환에 특이적인 소견은 아니다[21]. 특이적인 탈수초 소견으로는 양파껍질모양(onion bulb)이 있는데 이는 반복된 탈수초와 수초재생(remyelination)의 결과이며 주로 대표적인 유전말초신경병인 샤르코-마리-투스병 1형에서 관찰할 수 있다. 또 다른 특이 소견으로 토마큘라(tomacula)가 있는데 ‘소시지’라는 의미를 가진 용어로 수초가 국소적으로 부풀어 있는 모습을 묘사한 용어이며 압박마비취약유전신경병(hereditary neuropathy labile to pressure palsy, HNPP)에서 가장 잘 관찰된다.
근육과 신경은 신경과 의사가 생검을 통해 비교적 용이하게 획득할 수 있는 조직이지만, 침습적 술기를 동반하는 검사이다. 따라서, 생검의 시행에 대한 충분한 임상적 근거가 마련되어 있어야 할 것이며, 생검을 통해 관찰된 조직 소견을 잘 해석하여 진단에 유용한 정보를 획득할 수 있도록 최선을 다해야 한다. 또한, 적절하게 생검을 결정하였다고 하더라도 생검 부위를 잘못 선택한다면 이 역시 제대로 정보를 얻지 못하게 되는 중요한 원인이 된다. 따라서 생검에 앞서 충분한 임상평가가 이루어져야 할 것이며, 이를 바탕으로 적절한 생검대상을 선택하는 것이 무엇보다 중요하겠다.
본고에서 살펴본 바와 같이 대부분의 조직 소견은 질병 특이적인 경우보다 다양한 질환에서 공통적으로 나타나는 비특이적 소견인 경우가 더 많다. 그러므로 조직 소견에만 의존해서 세부진단에 이르려고 하는 것은 매우 위험할 수 있다. 가장 바람직한 것은 생검 이전에 충분히 임상평가를 시행해서 생검을 하였을 때 예상되는 조직 소견을 미리 염두에 두고 검사를 시행하는 것이다. 이렇게 해서 얻은 조직 소견을 임상 정보와 잘 연관하여 가장 적절한 진단에 이르도록 하거나 혹은 가장 적합한 다음 검사를 계획하도록 해야 한다.
생검을 통해 얻을 수 있는 조직 소견은 분명 매우 유용한 정보를 제공하고 진단에 뒷받침이 될 수 있는 중요한 수단이지만 이 검사를 더욱 가치 있게 만들어주는 것은 선행된 임상평가라는 것은 아무리 강조해도 지나치지 않을 것이다.
Fig. 1.
Normal muscle pathology. (A, B) Normal muscle fibers are polygonal-shaped, and there is a minimal amount of connective tissue between adjacent fibers. Nuclei are in the periphery of muscle fibers. (A) Hematoxylin and eosin, ×100. (B) Modified Gomori-trichrome, ×100. (C) Intermyofibrillar networks are intact in normal muscle fibers nicotinamide dehydrogenase-tetrazolium-reductase (×100). (D) No fibers are deficient in cytochrome C oxidase stain (×100). (E) Fiber types are differentiated. Type 1 fibers are darkly stained and Type 2 fibers are lightly stained. Adenosine phosphatase pH 4.3, ×100.
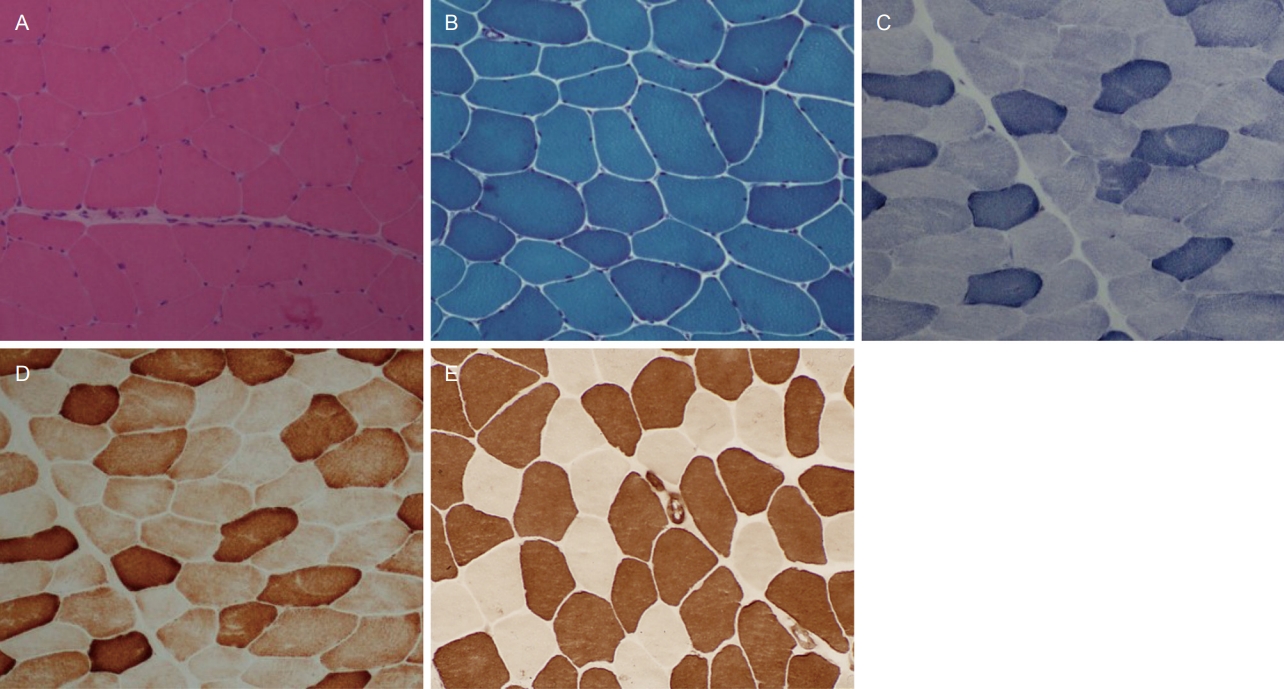
Fig. 2.
Muscle pathology in various myopathies. (A) Common myopathic pathology includes round muscle fibers with increased connective tissue between adjacent fibers, and an increased number of internal nuclei (hematoxylin and eosin [H&E], ×200). (B) In muscular dystrophies, there are hypertrophic as well as atrophic fibers, which increase fiber size variation (H&E, ×200). (C) Necrotic fibers have pale cytoplasm and recruit macrophages (H&E, ×200). (D) Regenerating fibers (arrows) have basophilic cytoplasm and enlarged nuclei inside (H&E ×200). (E) Inflammatory infiltration is highlighted in perimysium and perivascular regions (H&E, ×200). (F) Endomysial inflammation is surrounding and invading non-necrotic fiber in inclusion body myositis (H&E, ×200).
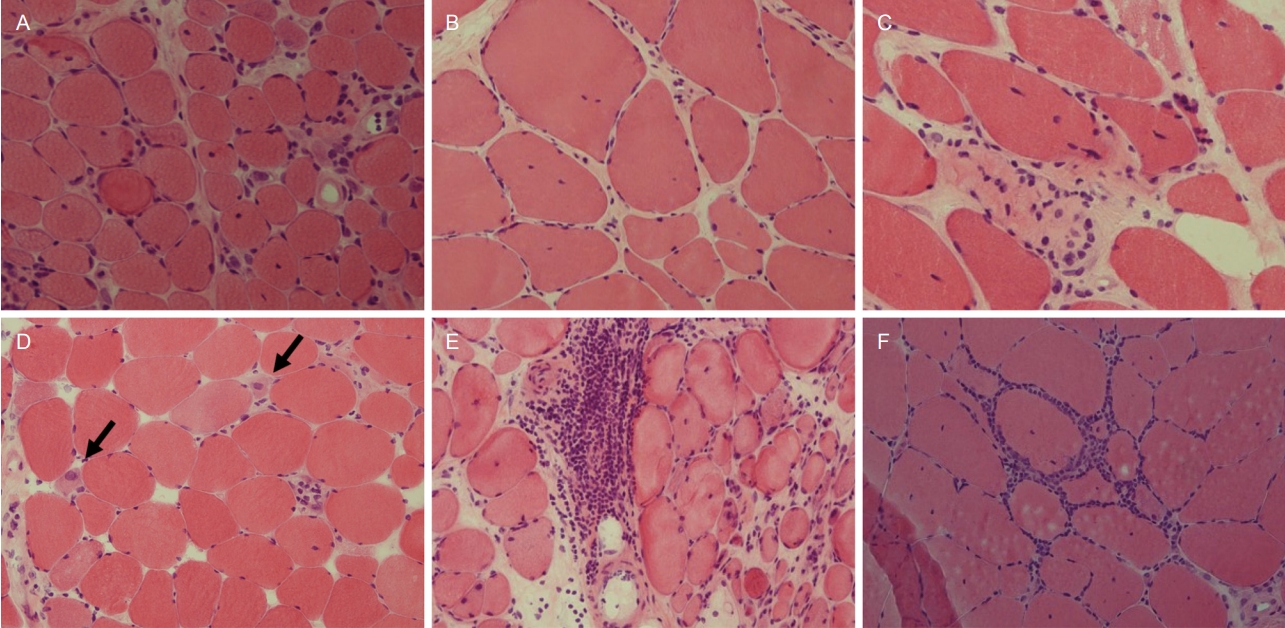
Fig. 3.
Myopathies with abnormal structures. (A) Vacuoles with red-colored rims are referred to as ‘rimmed vacuoles’ (modified Gomori-trichrome [MGT], ×200). (B) Muscle fibers in the periphery of fascicles are atrophied, which is called ‘perifascicular atrophy’ and a pathognomonic sign of dermatomyositis (MGT, ×100). (C) Central regions in each muscle fiber are deficient in nicotinamide dehydrogenase-tetrazolium-reductase (NADH-TR) stain, which is called ‘central cores’ and specifically found in central core disease (NADH-TR, ×200). (D) Almost all fibers have nuclei in the center of fibers, which are observed in centronuclear myopathy (hematoxylin and eosin [H&E], ×100). (E) Tiny, red rods were scattered or clustered inside of fibers. These are called ‘nemaline rods’ and are mostly found in nemaline myopathy (MGT, ×200). (F) Cytoplasmic bodies are highlighted as red, round cytoplasmic inclusion and their larger sizes are distinguished from nemaline bodies (MGT, ×200). (G) In myofibrillar myopathies, intermyofibrillar networks are frequently disorganized (NADH-TR, ×200).
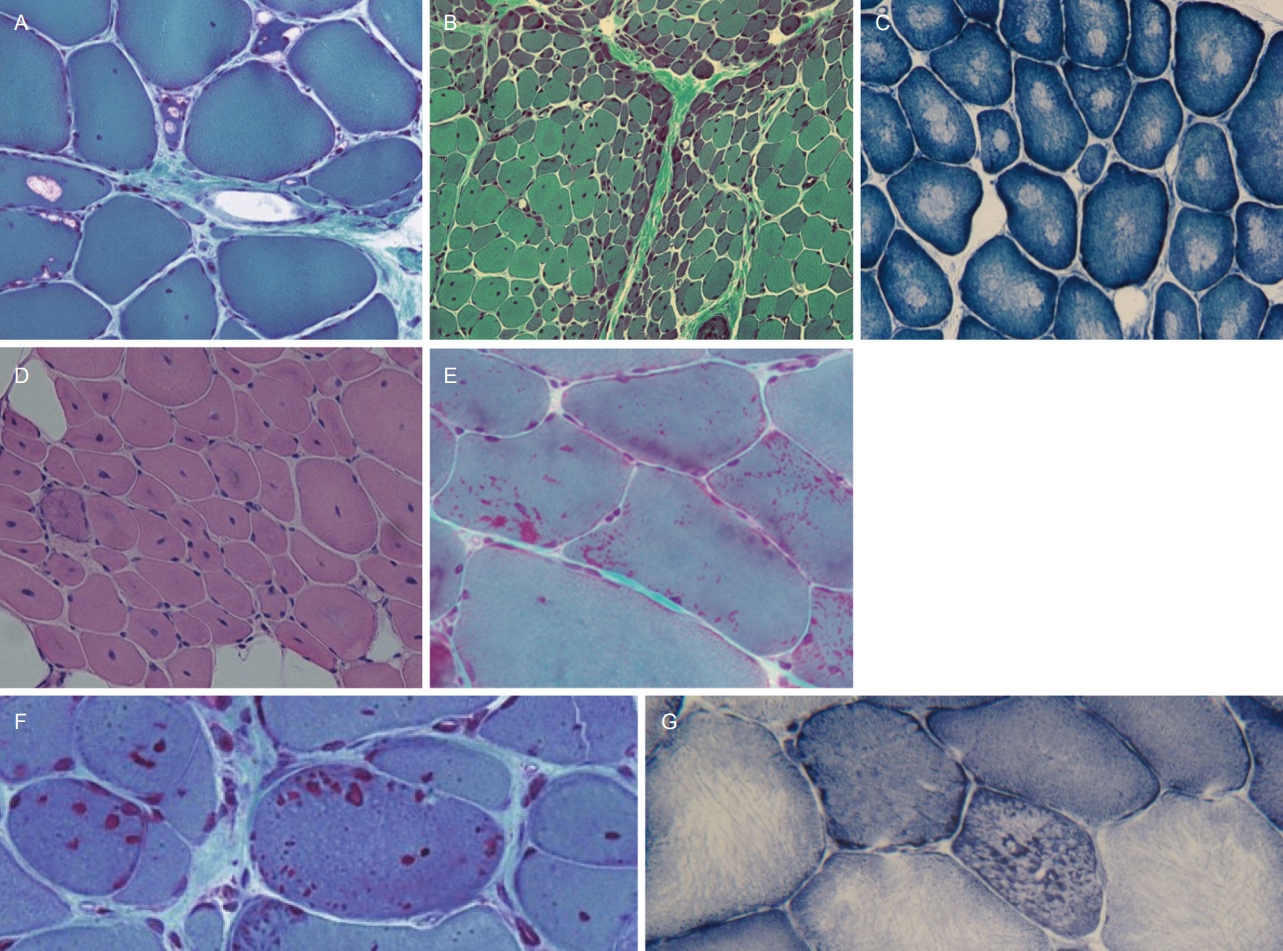
Fig. 4.
Mitochondrial myopathy and myopathies with abnormal metabolism. (A) Ragged red fibers (modified Gomori-trichrome [MGT], ×200) and (B) ragged blue fibers (succinate dehydrogenase, ×100) are highlighted in the mitochondrial myopathy. (C) Many fibers are deficient with cytochrome C oxidase (COX) activity in mitochondrial myopathy (COX, ×200). (D) Muscle fibers in glycogen storage disease are highly reactive for periodic acid Schiff (×200). (E) Red lipid droplets are highlighted in oil red O stain (×200).
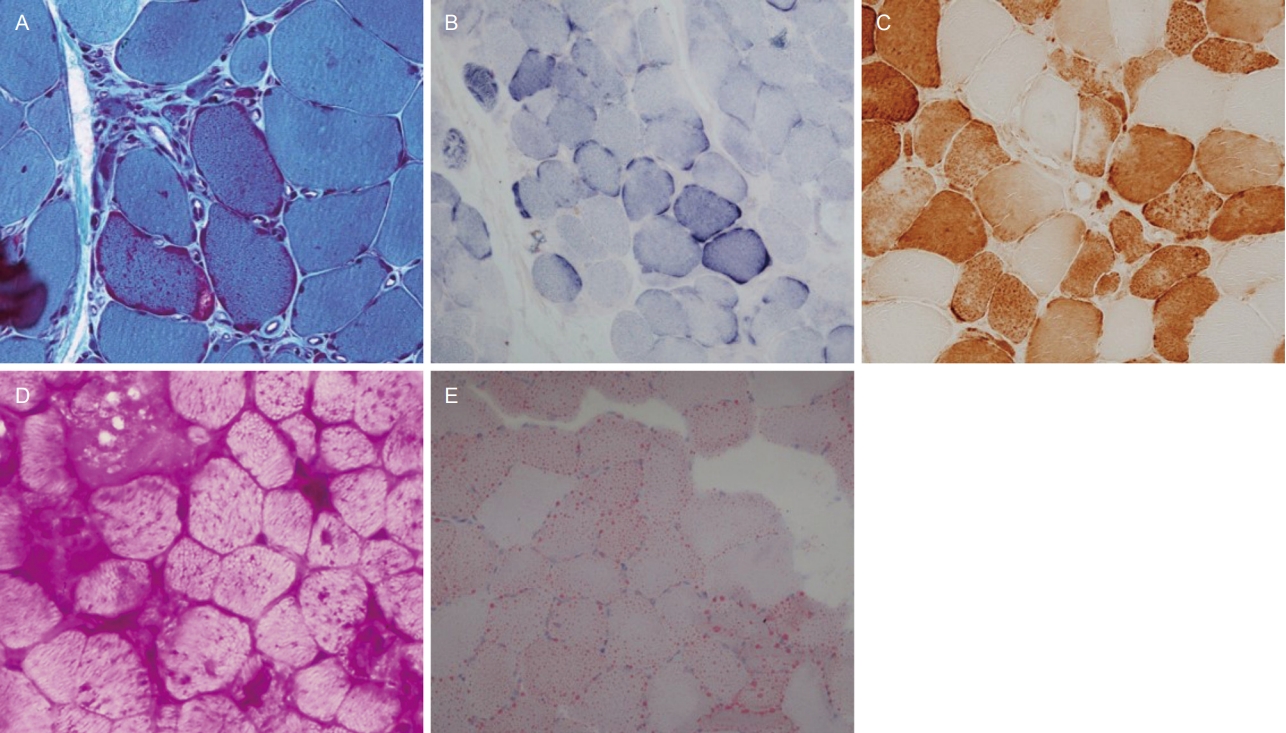
Fig. 5.
Neurogenic muscle pathology. (A) Angular atrophic fibers are clustered in neurogenic muscle pathology (hematoxylin and eosin [H&E], ×200). (B) Each fiber type is distributed in a group, which indicates fiber type grouping (BA-D5, ×200).

Fig. 6.
Normal and diseased nerve pathology. (A, B) Nerve fibers are densely packed in nerve fascicles. (A) Hematoxylin and eosin (H&E), ×100. (B) Modified Gomori-trichrome (MGT), ×200. (C) In a nerve fascicle with axonal degeneration, the density of myelinated nerve fibers are quite decreased and myelin-digestion chambers are visualized (MGT, ×200). (D) In demyelinating neuropathy, thin myelin sheaths are observed (MGT, ×100). (E) Vessels are occluded with thickened walls and axonal degeneration is combined (MGT, ×100). (F) In Congo red stain, red deposits are highlighted, which is indicative of amyloid deposits (Congo red, ×200).
REFERENCES
1. Dubowitz V, Sewry CA. The procedure of muscle biopsy. In: Dubowitz V, Sewry CA, Oldfors A, Lane R, eds. Muscle biopsy: a practical approach. 4th ed. London: Elsevier, 2013;2-15.
2. Kim DS. Diagnostic significance of immunohistochemical staining in muscular dystrophy. J Korean Neurol Assoc 2006;24:1-13.
3. Dubowitz V, Sewry CA. Normal muscle. In: Dubowitz V, Sewry CA, Oldfors A, Lane R, eds. Muscle biopsy: a practical approach. 4th ed. London: Elsevier, 2013;28-54.
4. Sewry CA, Goebel HH. General pathology of muscle disease. In: Goebel HH, Sewry CA, Weller RO, eds. Muscle disease: pathology and genetics. 2nd ed. Oxford: Wiley-Blackwell, 2013;19-31.
5. Dubowitz V, Sewry CA. Muscular dystrophies and allied disorders I: Duchenne and Becker muscular dystrophy. In: Dubowitz V, Sewry CA, Oldfors A, Lane R, eds. Muscle biopsy: a practical approach. 4th ed. London: Elsevier, 2013;250-275.
6. Dubowitz V, Sewry CA. Inflammatory myopathies. In: Dubowitz V, Sewry CA, Oldfors A, Lane R, eds. Muscle biopsy: a practical approach. 4th ed. London: Elsevier, 2013;513-538.
7. Tanboon J, Nishino I. Classification of idiopathic inflammatory myopathies: pathology perspectives. Curr Opin Neurol 2019;32:704-714.


8. Dubowitz V, Sewry CA. Congenital myopathies and related disorders. In: Dubowitz V, Sewry CA, Oldfors A, Lane R, eds. Muscle biopsy: a practical approach. 4th ed. London: Elsevier, 2013;358-405.
9. Jungbluth H. Core myopathies, malignant hyperthermia susceptibility, and Brody disease. In: Goebel HH, Sewry CA, Weller RO, eds. Muscle disease: pathology and genetics. 2nd ed. Oxford: Wiley-Blackwell, 2013;214-224.
10. Park YE, Choi YC, Bae JS, Lee CH, Kim HS, Shin JH, et al. Clinical and pathological features of Korean patients with DNM2-related centronuclear myopathy. J Clin Neurol 2014;10:24-31.



11. Romero NB, Laforte J. Centronuclear myopathies. In: Goebel HH, Sewry CA, Weller RO, eds. Muscle disease: pathology and genetics. 2nd ed. Oxford: Wiley-Blackwell, 2013;134-144.
13. Park YE, Kim DS, Choi YC, Shin JH. Progression of GNE myopathy based on the patient-reported outcome. J Clin Neurol 2019;15:275-284.




14. Malerba A, Klein P, Bachtarzi H, Jarmin SA, Cordova G, Ferry A, et al. PABPN1 gene therapy for oculopharyngeal muscular dystrophy. Nat Commun 2017;8:14848.




15. Ishiura H, Shibata S, Yoshimura J, Suzuki Y, Qu W, Doi K, et al. Noncoding CGG repeat expansions in neuronal intranuclear inclusion disease, oculopharyngodistal myopathy and an overlapping disease. Nat Genet 2019;51:1222-1232.



16. Dubowitz V, Sewry CA. Metabolic myopathies II: lipid-related disorders and mitochondrial myopathies. In: Dubowitz V, Sewry CA, Oldfors A, Lane R, eds. Muscle biopsy: a practical approach. 4th ed. London: Elsevier, 2013;446-484.
17. Dubowitz V, Sewry CA. Metabolic myopathies I: glycogenosis and lysosomal myopathies. In: Dubowitz V, Sewry CA, Oldfors A, Lane R, eds. Muscle biopsy: a practical approach. 4th ed. London: Elsevier, 2013;423-435.
18. Dubowitz V, Sewry CA. Neurogenic disorders. In: Dubowitz V, Sewry CA, Oldfors A, Lane R, eds. Muscle biopsy: a practical approach. 4th ed. London: Elsevier, 2013;235-249.
19. Oh SJ. The nerve biopsy. In: Oh SJ, eds. Color atlas of nerve biopsy pathology. 1st ed. Boca Raton: CRC Press, 2001.
20. Oh SJ. Normal nerve: histology. In: Oh SJ, eds. Color atlas of nerve biopsy pathology. 1st ed. Boca Raton: CRC Press, 2001.
21. Oh SJ. Specific diagnostic pathological features of nerve biopsy. In: Oh SJ, eds. Color atlas of nerve biopsy pathology. 1st ed. Boca Raton: CRC Press, 2001.
22. Oh SJ. Vasculitic neuropathy. In: Oh SJ, eds. Color atlas of nerve biopsy pathology. 1st ed. Boca Raton: CRC Press, 2001.
-
METRICS

-
- 0 Crossref
- Scopus
- 1,586 View
- 18 Download
- Related articles in Korean J Neuromuscul Disord
-
Autoantibody Testing in Neuromuscular Disorders2022 June;14(1)
Immunotherapy for Autoimmune Neuromuscular Diseases2015 December;7(2)
Treatment of Neuromuscular Junction Disorders2014 June;6(1)
Diagnosis of Myasthenia Gravis and Other Neuromuscular Junction Disorders2014 June;6(1)
Anatomy and Physiology of Neuromuscular Junction2014 June;6(1)





