 |
 |
- Search
| Korean J Neuromuscul Disord > Volume 14(1); 2022 > Article |
|
ABSTRACT
Autoantibodies are present in many autoimmune disorders, including diseases impacting the peripheral nerve, neuromuscular junction, and muscle. Some of these autoantibodies play a vital role in pathogenesis, whereas others are unlikely to be directly pathogenic, but may be useful biomarkers. The identification of autoantibodies is valuable in diagnosis, as well as in establishing a treatment plan in antibody-mediated neuromuscular disorders. This review briefly summarizes antibody, autoantibody, and methods of autoantibody testing for clinicians who treat patients with neuromuscular disorders.
ļ¦Éņ┤łņŗĀĻ▓ĮĻ│╝ ņŗĀĻ▓ĮĻĘ╝ņ£ĪņĀæĒĢ®ļČĆ ĻĘĖļ”¼Ļ│Ā ĻĘ╝ņ£ĪņŚÉļŖö ļ¦żņÜ░ ļŗżņ¢æĒĢ£ ļ│æļ”¼ĻĖ░ņĀäļōżļĪ£ ņØĖĒĢśņŚ¼ ņ¦łļ│æņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż. ĻĘĖņżæ ņ×ÉĻ░Ć ĒĢŁņ▓┤ņÖĆ ņŚ░Ļ┤ĆļÉ£ ņŗĀĻ▓ĮĻĘ╝ņ£Īņ¦łĒÖśļōżņØ┤ ņ׳ņ£╝ļ®░, ņØ┤ļōż ņ¦łĒÖśļōżņŚÉļŖö ļ│┤ĒåĄ ĒÜ©Ļ│╝ņĀüņØĖ ņ╣śļŻīļ▓ĢļōżņØ┤ ņ׳ņ¢┤, ņŗĀĻ▓ĮĻĘ╝ņ£Īņ¦łĒÖśņØä ļŗżļŻ©ļŖö ņØśņé¼ļōżņØĆ ņŗĀĻ▓ĮĻĘ╝ņ£Īņ¦łĒÖś ĒÖśņ×ÉļōżņØś ņ¦äļŗ©Ļ│╝ņĀĢņŚÉ ņ×ÉĻ░ĆĒĢŁņ▓┤ļź╝ ņ░Šņ£╝ļĀżļŖö Ļ▓Ćņé¼ļź╝ ņ×ÉņŻ╝ ņŗ£Ē¢ēĒĢ£ļŗż. ļ│ĖĻ│Āļź╝ ĒåĄĒĢśņŚ¼ ņŗĀĻ▓ĮĻĘ╝ņ£Īņ¦łĒÖś ĒÖśņ×Éļź╝ ņ¦äļŻīĒĢśļŖö ņØśņé¼ļōżņŚÉĻ▓ī ņ×ÉĻ░ĆĒĢŁņ▓┤ņÖĆ ņ×ÉĻ░ĆĒĢŁņ▓┤Ļ▓Ćņé¼ņŚÉ ļīĆĒĢśņŚ¼ ņØ┤ĒĢ┤ĒĢśļŖö ļŹ░ ļÅäņøĆņØ┤ ļÉśļŖö ĻĖ░ļ│ĖņĀüņØĖ ļé┤ņÜ®ņØä ņé┤ĒÄ┤ļ│┤Ļ│Āņ×É ĒĢ£ļŗż. ņ×ÉĻ░Ćļ®┤ņŚŁĻ│╝ ņ×ÉĻ░ĆĒĢŁņ▓┤ ĒśĢņä▒ņŚÉ Ļ┤ĆļĀ©ļÉśņ¢┤ ņóĆ ļŹö Ļ╣ŖņØ┤ ņĢīņĢäļ│┤ĻĖ░ļź╝ ņøÉĒĢĀ Ļ▓ĮņÜ░ ņØ┤ ņŻ╝ņĀ£ļź╝ ņ▓┤Ļ│äņĀüņ£╝ļĪ£ ņל ņĀĢļ”¼ĒĢ£ ļ¼ĖĒŚīļōżņØä ņČöņ▓£ĒĢ£ļŗż[1,2].
ĒĢŁņ▓┤ļŖö ĒŖ╣ņĀĢ ļ¼╝ņ¦ł, ļ│┤ĒåĄņØĆ ļ»ĖņāØļ¼╝ļōżĻ│╝ Ļ░ÖņØ┤ ņŻ╝ļ│Ć ĒÖśĻ▓ĮņŚÉņä£ ņÜ░ļ”¼ ļ¬Ėņ£╝ļĪ£ ļōżņ¢┤ņś© ņÖĖļČĆļ¼╝ņ¦łļōżņŚÉ ĒŖ╣ņØ┤ņĀüņ£╝ļĪ£ Ļ▓░ĒĢ®ĒĢśļŖö ļŗ╣ļŗ©ļ░▒ņ¦ł(glycoprotein)ļĪ£ ļ®┤ņŚŁņŚÉņä£ ļ¦żņÜ░ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ņ¦ĆļŗłĻ│Ā ņ׳ļŗż[3]. ĒĢŁņ▓┤Ļ░Ć Ļ▓░ĒĢ®ĒĢśļŖö ļ¼╝ņ¦łņØä ĒĢŁņøÉ(antigen)ņØ┤ļØ╝ ļČĆļźĖļŗż. ņé¼ļ×īņØś ĒĢŁņ▓┤ļŖö ļŗżņä» Ļ░Ćņ¦Ć ņóģļźś(class)Ļ░Ć ņ׳Ļ│Ā ņ┤Ø 9Ļ░Ćņ¦ĆņØś ņĢäņØ┤ņåīĒāĆņ×ģ(isotype)ņØ┤ ņ׳ļŗż. ņØ┤ļōżņØĆ Ļ░üĻ░ü ļŗżļźĖ ĒŖ╣ņä▒ņØä ļ│┤ņØ┤ņ¦Ćļ¦ī ĻĖ░ļ│ĖņĀüņ£╝ļĪ£ ļäż Ļ░£ņØś ņé¼ņŖ¼ ĻĄ¼ņĪ░ļź╝ Ļ│Ąņ£ĀĒĢ£ļŗż(Fig. 1) [4]. ĒĢŁņ▓┤ņØś ĻĖ░ļ│Ė ĻĄ¼ņĪ░ļŖö ļæÉ Ļ░£ņØś ņżæņé¼ņŖ¼(heavy chain)Ļ│╝ ļæÉ Ļ░£ņØś Ļ▓Įņé¼ņŖ¼(light chain)ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŗż. ĻĘĖļ”¼Ļ│Ā ĒĢŁņ▓┤ņŚÉ ĒīīĒīīņØĖ(papain) ĒÜ©ņåīļź╝ ņ▓śļ”¼ĒĢśļ®┤ ĒĢŁņ▓┤Ļ░Ć Ēü¼Ļ▓ī ļæÉ ņóģļźśņØś ņĪ░Ļ░ü(fragment)ņ£╝ļĪ£ ņלļ”¼ļŖöļŹ░ ĒĢŁņøÉĻ│╝ Ļ▓░ĒĢ®ĒĢśļŖö ņĪ░Ļ░üņØä antigen binding fragment (Fab), Ļ▓░ņĀĢ(crystal)ņØä ņØ┤ļŻ©ļŖö ņĪ░Ļ░üņØä crystallizable fragment (Fc)ļĪ£ ļČĆļźĖļŗż. Ļ░üĻ░üņØś ņżæņé¼ņŖ¼Ļ│╝ Ļ▓Įņé¼ņŖ¼ņØś N-ļ¦Éļŗ© ļČĆņ£äļŖö ļ│ĆņØ┤ļČĆņ£ä(variable region)ļĪ£ ĒĢŁņøÉĻ│╝ ņāüĒśĖ ņ×æņÜ®ņØä ĒĢśļŖö ļČĆļČäņØ┤ļŗż. Ļ░ü ņé¼ņŖ¼ņØś ĻĘĖ ņØ┤ņÖĖņØś ļČĆļČäņØĆ ļČłļ│ĆļČĆņ£ä(constant region)ņ£╝ļĪ£ ļČłļ”░ļŗż. ņżæņé¼ņŖ¼ ļČłļ│ĆļČĆņ£äņØś ņóģļźśņŚÉ ļö░ļØ╝ ĒĢŁņ▓┤ņØś ņóģļźśļź╝ ĻĄ¼ļČäĒĢ£ļŗż. ĒĢŁņ▓┤ ņāØņä▒ BņäĖĒżĻ░Ć ļČäĒÖöĒĢśļ®┤ņä£ ņżæņé¼ņŖ¼ ļČłļ│ĆļČĆņ£äņØś ņ£ĀņĀäņ×É ņ×¼ņĪ░ĒĢ®ņØ┤ ņØ╝ņ¢┤ļéśĻ│Ā ĻĘĖ Ļ▓░Ļ│╝ņŚÉ ļö░ļØ╝ immunoglobulin M (IgM), IgD, IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgE ņżæ ĒĢ£ ņóģļźśņØś ĒĢŁņ▓┤Ļ░Ć ņāØņä▒ļÉ£ļŗż[5]. IgMņØĆ ņśżĒĢ®ņ▓┤(pentamer) Ēś╣ņØĆ ņ£ĪĒĢ®ņ▓┤(hexamer)ļź╝ ņØ┤ļŻ©Ļ│Ā ļīĆļČĆļČäņØś ļ»ĖņāØļ¼╝ņŚÉ ļéśĒāĆļéśļŖö ļ░śļ│ĄņĀüņØĖ ļ¬©Ēŗ░Ēöä(motif)ļź╝ ņ¦Ćļŗī ĒĢŁņøÉņŚÉ ņל ļČÖļŖö ĒŖ╣ņä▒ņØä ņ¦Ćļŗłļ®░ ļ│┤ņ▓┤ļź╝ ĒÖ£ņä▒ĒÖöņŗ£Ēé¼ ņłś ņ׳ļŗż. IgMņØĆ ĻĘĖ Ēü¼ĻĖ░ ļĢīļ¼ĖņŚÉ ļīĆļČĆļČä ĒśłĻ┤Ć ļé┤ņŚÉ ņĪ┤ņ×¼ĒĢ£ļŗż. ņØ┤ņŚÉ ļ░śĒĢśņŚ¼ IgGļŖö Ēśłņ▓ŁņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ņŻ╝ļÉ£ ĒĢŁņ▓┤ļĪ£ ņĀäņ▓┤ ĒĢŁņ▓┤ ņ¢æņØś 70-75%ļź╝ ņ░©ņ¦ĆĒĢśļ®░, IgMĻ│╝ļŖö ļŗ¼ļ”¼ ļ│ĄĒĢ®ņ▓┤ļź╝ ĒśĢņä▒ĒĢśņ¦Ć ņĢŖĻ│Ā Ēü¼ĻĖ░Ļ░Ć Ēü¼ņ¦Ć ņĢŖņĢä ĒśłĻ┤Ć ļ░¢ņ£╝ļĪ£ ļ╣ĀņĀĖļéśĻ░Ć ņĪ░ņ¦üņŚÉ ļČäĒżĒĢĀ ņłś ņ׳ļŗż. ņé¼ļ×īņŚÉņä£ IgG1Ļ│╝ IgG3ļŖö ļ░öņØ┤ļ¤¼ņŖż(virus)ņŚÉ ļīĆĒĢśņŚ¼ ĒÜ©Ļ│╝ņĀüņØ┤ļ®░, IgG2ļŖö Ēö╝ļ¦ē(encapsulated) ņäĖĻĘĀņŚÉ, ĻĘĖļ”¼Ļ│Ā IgG4ļŖö ņäĖĒż ļ░¢ Ēü░ ĻĖ░ņāØņČ®ņŚÉ ļīĆĒĢśņŚ¼ ĒÜ©Ļ│╝ņĀüņØ┤ļŗż. IgG1Ļ│╝ IgG3ļŖö ļ│┤ņ▓┤ļź╝ ņל ĒÖ£ņä▒ĒÖöņŗ£Ēéżņ¦Ćļ¦ī IgG4ļŖö ļ│┤ņ▓┤ļź╝ ĒÖ£ņä▒ĒÖöņŗ£Ēéżņ¦Ć ļ¬╗ĒĢ£ļŗż. ņØ┤ļ¤¼ĒĢ£ ĒĢŁņ▓┤ņØś ņóģļźśņŚÉ ļö░ļźĖ ĻĖ░ļŖźņØĆ ņżæņé¼ņŖ¼ņØś ļČłļ│ĆļČĆņ£äņŚÉ ļö░ļØ╝ Ļ▓░ņĀĢļÉ£ļŗż. ĒĢŁņ▓┤ņØś FcĻ░Ć ņŚ¼ļ¤¼ ņäĖĒżļōżņØś Ēæ£ļ®┤ņŚÉ ļ░£ĒśäļÉ£ FcņłśņÜ®ņ▓┤ (Fc receptor, FcR)ļéś ļ│┤ņ▓┤Ļ│äņØś ļŗ©ļ░▒ņ¦łļōżĻ│╝ Ļ▓░ĒĢ®ĒĢśņŚ¼ ĒŖ╣ņĀĢ ļ░śņØæļōżņØ┤ ņØ╝ņ¢┤ļéśĻ▓ī ļÉ£ļŗż[6].
ĒĢŁņ▓┤ļŖö ļ¦żņÜ░ ļŗżņ¢æĒĢ£ ĒĢŁņøÉļōżņŚÉ Ļ▓░ĒĢ®ĒĢĀ ņłś ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ļŗżņ¢æņä▒ņØĆ ļ®┤ņŚŁņØś ĒĢĄņŗ¼ ĒŖ╣ņ¦Ģ ņżæ ĒĢśļéśņØ┤ļŗż. ĒĢŁņ▓┤-Ļ┤ĆļĀ© ņ£ĀņĀäņ×ÉļōżņØś ņ×¼ņĪ░ĒĢ®Ļ│╝ ņ▓┤ņäĖĒżņ┤łļÅīņŚ░ļ│ĆņØ┤(somatic hypermutation)ņÖĆ Ļ░ÖņØĆ ĻĖ░ņĀäņØä ĒåĄĒĢśņŚ¼ ļŗżņ¢æĒĢ£ ļ¼╝ņ¦łļōżņŚÉ ļīĆņØæĒĢśļŖö ĒĢŁņ▓┤Ļ░Ć ĒśĢņä▒ļÉ£ļŗż[1]. ņØ┤ļ¤¼ĒĢ£ ļŗżņ¢æĒĢ£ ĒĢŁņ▓┤ļōżņØĆ ļ¦żņÜ░ Ļ┤æļ▓öņ£äĒĢ£ ņÖĖļČĆ ĒĢŁņøÉļōżļĪ£ļČĆĒä░ ņÜ░ļ”¼ ļ¬ĖņØä ļ│┤ĒśĖĒĢśļŖö ņŚŁĒĢĀņØä ĒĢ£ļŗż. ĒĢśņ¦Ćļ¦ī ļ░öļĪ£ ĻĘĖ ļŗżņ¢æņä▒ņØĆ ĒĢäņŚ░ņĀüņ£╝ļĪ£ ņÜ░ļ”¼ ļ¬ĖņØä ĻĄ¼ņä▒ĒĢśļŖö ļ¼╝ņ¦łņŚÉ ļīĆĒĢ£ ĒĢŁņ▓┤Ļ░Ć ĒśĢņä▒ļÉĀ ņ£äĒŚśņä▒ļÅä ĒĢ©Ļ╗ś ļČłļ¤¼ņś©ļŗż. ņÜ░ļ”¼ ļ¬Ė ļ░¢ņŚÉņä£ ļōżņ¢┤ņś© ĒĢŁņøÉņØ┤ ņĢäļŗī ņÜ░ļ”¼ ļ¬ĖņŚÉ ņĀĢņāüņĀüņ£╝ļĪ£ ņĪ┤ņ×¼ĒĢśļŖö ĒĢŁņøÉņŚÉ ļ░śņØæņØä ĒĢśļŖö ĒĢŁņ▓┤ļź╝ ņ×ÉĻ░ĆĒĢŁņ▓┤(autoantibody)ļØ╝ ļČĆļźĖļŗż. ĒĢŁņ▓┤ļŖö BņäĖĒżļōżņØ┤ ļČäĒÖö ņä▒ņłÖļÉśļ®┤ņä£ ņāØņä▒ļÉ£ļŗż. ņÜ░ļ”¼ ļ¬ĖņŚÉļŖö BņäĖĒżņØś ļČäĒÖö ņä▒ņłÖ Ļ│╝ņĀĢ ņżæ ĒŖ╣ņĀĢ ļŗ©Ļ│äņŚÉ ņåīņ£ä Ļ▓Ćļ¼Ėņåī(checkpoint)Ļ░Ć ņ׳ņ¢┤ ņ×ÉĻ░Ćļ░śņØæ(autoreactive) BņäĖĒżļōżņØ┤ ņé¼ļ®ĖļÉśĻ▒░ļéś BņäĖĒżņłśņÜ®ņ▓┤ļź╝ ļ░öĻŠĖņ¢┤ ņ×ÉĻ░Ćļ░śņØæ ĒŖ╣ņä▒ņØä ņŚåņĢĀĻ▒░ļéś Ēś╣ņØĆ ļ¼┤ļ░śņØæ(anergy) ņāüĒā£ļź╝ ņ£Āņ¦ĆĒĢśļŖö ļō▒ņØś ĻĖ░ņĀäņ£╝ļĪ£ ņ×ÉĻ░Ćļ®┤ņŚŁļ░śņØæņØä ņĄ£ņåīĒÖöĒĢ£ļŗż[7-10]. ņØ┤ļ¤¼ĒĢ£ ļ®┤ņŚŁņÜ®ņØĖ(immune tolerance) ĻĖ░ņĀäņØ┤ ņל ņ×æļÅÖĒĢśņ¦Ć ņĢŖĻ▒░ļéś BņäĖĒżļōżņØ┤ ļ®┤ņŚŁņÜ®ņØĖĻĖ░ņĀäņØä ĒÜīĒö╝ĒĢśļ®┤ ņ×ÉĻ░ĆĒĢŁņ▓┤Ļ░Ć ļ¦īļōżņ¢┤ņ¦ł ņłś ņ׳ļŗż[1].
ņ×ÉĻ░ĆĒĢŁņ▓┤ļŖö ĒĢŁņøÉņØś ņ£äņ╣śņŚÉ ļö░ļØ╝ ņäĖĒżļ░öĻ╣ź(extracelluar) ĒĢŁņøÉņŚÉ ļīĆĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ņÖĆ ņäĖĒżļé┤(intracellular) ĒĢŁņøÉņŚÉ ļīĆĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ļĪ£ ĻĄ¼ļČäĒĢĀ ņłś ņ׳ļŗż[11]. ņäĖĒżļ░öĻ╣ź ĒĢŁņøÉņ£╝ļĪ£ļŖö ņłśņÜ®ņ▓┤(receptor), ĒåĄļĪ£(channel), ņäĖĒżļČĆņ░®ļČäņ×É(cell adhesion molecule) ļō▒ ņäĖĒżļ¦ēļŗ©ļ░▒(membrane protein)ņØś ņäĖĒżļ░öĻ╣źņśüņŚŁ(extracellular domain) Ēś╣ņØĆ ņäĖĒżņŚÉņä£ ņāØņä▒ļÉśņ¢┤ ņäĖĒżļ░öĻ╣źņ£╝ļĪ£ ļČäļ╣äļÉśļŖö ļŗ©ļ░▒(secretory protein) ļō▒ņØ┤ ņ׳ļŗż. ņØ┤ļōż ņäĖĒżļ░öĻ╣ź ĒĢŁņøÉņŚÉ ļīĆĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ļŖö ĒĢŁņøÉĻ│╝ Ļ▓░ĒĢ®ĒĢśņŚ¼ ĒĢ┤ļŗ╣ ļŗ©ļ░▒ņØś ĻĖ░ļŖźņØä ļ░®ĒĢ┤ĒĢśĻ▒░ļéś ĒĢ┤ļŗ╣ ļŗ©ļ░▒ņØä ņäĖĒżļé┤ļĪ£ ļé┤ņ×¼ĒÖö(internalization) ĒĢśņŚ¼ ņäĖĒżļ¦ēņŚÉņä£ ĻĘĖ ļŗ©ļ░▒ņØś ņ¢æņØä Ļ░Éņåīņŗ£ĒéżĻ▒░ļéś ļ│┤ņ▓┤ ĒÖ£ņä▒ĒÖöļź╝ ĒåĄĒĢśņŚ¼ ņäĖĒżļ¦ēņØä ņåÉņāüņŗ£ĒéżļŖö ļō▒ņØś ĻĖ░ņĀäņ£╝ļĪ£ ņ¦łļ│æņØä ņØ╝ņ£╝Ēé¼ ņłś ņ׳ļŗż. ņ×ÉĻ░ĆĒĢŁņ▓┤ņØś ņĢäņØ┤ņåīĒāĆņ×ģņØ┤ IgG4ņØĖ Ļ▓ĮņÜ░ļŖö ļ│┤ņ▓┤ļź╝ ĒÖ£ņä▒ĒÖöņŗ£Ēéżņ¦Ć ļ¬╗ĒĢśņŚ¼ ņØ╝ļ░śņĀüņ£╝ļĪ£ ņżæņÜöĒĢ£ ļŗ©ļ░▒ņØś ĻĖ░ļŖźņØä ļ░®ĒĢ┤ĒĢśļŖö ĻĖ░ņĀäņ£╝ļĪ£ ņ¦łļ│æņØä ņØ╝ņ£╝ĒéżļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[12]. ņŗĀĻ▓ĮĻĘ╝ņ£Īņ¦łĒÖśĻ│╝ ņŚ░Ļ┤ĆļÉ£ ļīĆĒæ£ņĀüņØĖ ņäĖĒżļ░öĻ╣źĒĢŁņøÉņŚÉ ļīĆĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ļĪ£ļŖö ņżæņ”ØĻĘ╝ļ¼┤ļĀźņ”ØĻ│╝ ņŚ░Ļ┤ĆļÉ£ ĒĢŁ-ņĢäņäĖĒŗĖņĮ£ļ”░ ņłśņÜ®ņ▓┤(acetylcholine receptor) ĒĢŁņ▓┤ņÖĆ ĒĢŁ-MuSK ĒĢŁņ▓┤, ļשļ▓äĒŖĖņØ┤ĒŖ╝ĻĘ╝ļ¼┤ļĀźņ”ØĒøäĻĄ░Ļ│╝ ņŚ░Ļ┤ĆļÉ£ ĒĢŁ-P/QĒśĢņĀäņĢĢņØśņĪ┤ņä▒ņ╣╝ņŖśĒåĄļĪ£(P/Q type voltage-gated calcium channel) ĒĢŁņ▓┤, ĻĖĖļף-ļ░öļĀłņ”ØĒøäĻĄ░(Gullian-Barre syndrome)Ļ│╝ Ēö╝ņģöņ”ØĒøäĻĄ░(Fisher syndrome)Ļ│╝ ņŚ░Ļ┤ĆļÉ£ ĒĢŁ-Ļ░ĢĻĖĆļ”¼ņśżņé¼ņØ┤ļō£(ganglioside) ĒĢŁņ▓┤ļōż, ļ¦Éņ┤łņŗĀĻ▓ĮņØś Ēāłņłśņ┤łņ¦łĒÖśĻ│╝ ņŚ░Ļ┤ĆļÉ£ neurofascin-155 ļō▒ ļ×æļ╣äņŚÉļź┤Ļ▓░ņĀł(node of Ranvier)ņŚÉ ņ£äņ╣śĒĢ£ ļŗ©ļ░▒ļōżņŚÉ ļīĆĒĢ£ ĒĢŁņ▓┤ ļō▒ņØ┤ ņ׳ļŗż[13-16]. ņØ┤ ņ×ÉĻ░ĆĒĢŁņ▓┤ļōż ņżæ ĒĢŁ-MuSKņÖĆ ĒĢŁ-neurofascin-155 ņ×ÉĻ░ĆĒĢŁņ▓┤ļōżņØĆ ņŻ╝ļÉ£ ĒĢŁņ▓┤ ņĢäņØ┤ņåīĒāĆņ×ģņØ┤ IgG4ņØ┤ļ®░, ņØ┤ ĒĢŁņ▓┤ņÖĆ ņŚ░Ļ┤ĆļÉ£ ņ¦łĒÖśņØś Ļ▓ĮņÜ░ ĒśłņןĻĄÉĒÖśņłĀņØ┤ļéś ļ”¼ĒłŁņŗ£ļ¦Ö ļō▒ BņäĖĒżļź╝ Ļ│ĀĻ░łņŗ£ĒéżļŖö ņ╣śļŻīņŚÉ ĒÜ©Ļ│╝Ļ░Ć ņóŗņØĆ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż [12].
ņäĖĒżļ░öĻ╣źĒĢŁņøÉņŚÉ ļīĆĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ņŚÉ ļ╣äĒĢśņŚ¼ ņäĖĒżļé┤ĒĢŁņøÉņŚÉ ļīĆĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤Ļ░Ć ņ¦łļ│æņØä ņ£Āļ░£ĒĢśļŖöņ¦ĆļŖö ņל ņĢīļĀżņĀĖ ņ׳ņ¦Ć ņĢŖļŗż[11]. ņØ┤ļōż ĒĢŁņ▓┤ļŖö ņäĖĒżļé┤ĒĢŁņøÉņŚÉ ļīĆĒĢ£ TņäĖĒż-ļ¦żĻ░£ ļ®┤ņŚŁļ░śņØæņØ┤ ņ׳ņØīņØä ļ░śņśüĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņŚ¼Ļ▓©ņ¦Ćņ¦Ćļ¦ī, ņ×ÉĻ░ĆĒĢŁņ▓┤Ļ░Ć ņäĖĒżļé┤ ĒĢŁņøÉņŚÉ ņĀæĻĘ╝ĒĢśņŚ¼ Ļ▓░ĒĢ®ĒĢśĻĖ░Ļ░Ć ņ¢┤ļĀĄĻĖ░ ļĢīļ¼ĖņŚÉ ņ¦üņĀæņĀüņ£╝ļĪ£ ņ¦łļ│æņØä ņ£Āļ░£ĒĢśņ¦ĆļŖö ļ¬╗ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ░øņĢäļōżņŚ¼ņ¦ĆĻ│Ā ņ׳ļŗż[17]. ĒĢśņ¦Ćļ¦ī, ĒĢŁņøÉ-ĒĢŁņ▓┤ ļ│ĄĒĢ®ņ▓┤ ĒśĢņä▒, ņŚ╝ņ”ØņŚ░ņćäļ░śņØæņØś ĒÖ£ņä▒, ļīĆņŗØņäĖĒż(macrophage)ņØś ĒĢŁņøÉņĀ£ņŗ£(antigen presentation) ņ”ØĻ░Ć ļō▒ņØś ĻĖ░ņĀäņ£╝ļĪ£ Ļ░äņĀæņĀüņ£╝ļĪ£ ļ░£ļ│æņŚÉ ĻĖ░ņŚ¼ĒĢĀ Ļ░ĆļŖźņä▒ņØĆ ņ׳ļŗż[18]. ņŗĀĻ▓ĮĻĘ╝ņ£Īņ¦łĒÖśĻ│╝ ņŚ░Ļ┤ĆļÉ£ ļīĆĒæ£ņĀüņØĖ ņäĖĒżļé┤ĒĢŁņøÉņŚÉ ļīĆĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ļĪ£ļŖö ņŚ╝ņ”ØĻĘ╝ņ£Īļ│æ(inflammatory myopathy)Ļ│╝ ņŚ░Ļ┤ĆļÉ£ ĒĢŁ-Jo-1 ĒĢŁņ▓┤, ĒĢŁ-SRP ĒĢŁņ▓┤, ĒĢŁ-HMGCR ĒĢŁņ▓┤ ļō▒Ļ│╝ ņŗĀņāØļ¼╝ļöĖļ”╝ĒĢŁņ▓┤(paraneoplastic antibody) ļō▒ņØ┤ ņ׳ļŗż[16,19].
ļ¬©ļōĀ ņ×ÉĻ░ĆĒĢŁņ▓┤Ļ░Ć ņ¦łļ│æņØä ņØ╝ņ£╝ĒéżļŖö Ļ▓āņØĆ ņĢäļŗłļ®░, ņØ╝ļČĆ ņ×ÉĻ░ĆĒĢŁņ▓┤ļŖö ņÜ░ļ”¼ ļ¬ĖņØä ļ│┤ĒśĖĒĢśļŖö ĻĖ░ļŖźņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ļÅä ļ│┤ņØĖļŗż[20]. ņÜ░ļ”¼ ļ¬ĖņŚÉļŖö ĒĢŁņøÉņØś ņ×ÉĻĘ╣ņØä ļ░øņØĆ Ļ▓ĮĒŚśņØ┤ ņŚåņØ┤ ņ×ÉņŚ░ņĀüņ£╝ļĪ£ ņāØĻ▓©ļé£ ĒĢŁņ▓┤, ņ”ē ņ×ÉņŚ░ĒĢŁņ▓┤(natural antibody)ļÅä ņāØņä▒ļÉ£ļŗż. ņ×ÉņŚ░ĒĢŁņ▓┤ļŖö Ļ▒░ņØś ļīĆļČĆļČä IgMņ£╝ļĪ£ ņĪ┤ņ×¼ĒĢśļ®░ ĒŖ╣ņĀĢ ņ×ÉņŚ░ĒĢŁņ▓┤ļŖö ņŚ╝ņ”ØĻ│╝ ņ×ÉĻ░Ćļ®┤ņŚŁņ¦łĒÖśņØś ļ░£ņāØņØä ņ¢ĄņĀ£ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. IgMņØ┤ ņāØņä▒ļÉśņ¦Ć ņĢŖļŖö ļÅÖļ¼╝ļ¬©ļŹĖņŚÉņä£ ņ×ÉĻ░Ćļ®┤ņŚŁ Ļ░Éņłśņä▒ņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā ņäĖĒżĒĢĄļé┤ ĒĢŁņøÉņŚÉ ļīĆĒĢ£ IgG ņ×ÉĻ░ĆĒĢŁņ▓┤Ļ░Ć ĒśĢņä▒ļÉśĻ│Ā ļŻ©ĒöäņŖż(lupus)ņØś ņ×äņāü ĒŖ╣ņ¦ĢņØ┤ ļéśĒāĆļé£ļŗż. ņĀäņŗĀĒÖŹļ░śļŻ©ĒöäņŖż(systemic lupus erythematosus) ĒÖśņ×É ņĮöĒśĖĒŖĖ ņŚ░ĻĄ¼ņŚÉņä£ Ļ▒┤Ļ░ĢļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ĒÖśņ×ÉĻĄ░ņŚÉņä£ ņäĀĒāØņĀüņ£╝ļĪ£ IgMņØ┤ Ļ▓░ĒĢŹļÉśņ¢┤ ņ׳ņŚłĻ│Ā IgM ļåŹļÅäņÖĆ ņ¦łļ│æņØś ņ£Āļ│æĻĖ░Ļ░ä ņé¼ņØ┤ņŚÉ ņŚ░Ļ┤Ćņä▒ņØ┤ ņ׳ņŚłļŗż[21,22]. ļŗżļ░£Ļ▓ĮĒÖöņ”ØņØś ļÅÖļ¼╝ļ¬©ļŹĖņŚÉņä£ ņ×ÉņŚ░ĒĢŁņ▓┤ņØĖ SCH94.03Ļ░Ć ĒؼņåīļÅīĻĖ░ņĢäĻĄÉņäĖĒż(oligodendrocyte)ņŚÉ ļČÖĻ│Ā ņ╣╝ņŖśņŗĀĒśĖņĀäļŗ¼(calcium signaling)ņØä ņ£ĀļÅäĒĢśļ®░ ņłśņ┤łņ×¼ņāØ(remyelination)ņØä ņ┤ēņ¦äĒĢśļŖö ĒśäņāüņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż[23,24].
ņ¦äļŗ©Ļ▓Ćņé¼ņŗżņŚÉņä£ ļ¬ć Ļ░Ćņ¦Ć ņŻ╝ņÜöĒĢ£ ĒĢŁņ▓┤ļź╝ ņ░ŠļŖö Ļ▓Ćņé¼ļ▓ĢļōżņØ┤ ņØ┤ņÜ®ļÉ£ļŗż. ļ®┤ņŚŁņĪ░ņ¦üĒÖöĒĢÖ Ēś╣ņØĆ ļ®┤ņŚŁĒśĢĻ┤æļ▓ĢņØĆ ņ¢ćĻ▓ī ņ×ÉļźĖ ņŗżĒŚśņźÉņØś ņĪ░ņ¦üņŚÉ Ēśłņ▓Ł ļō▒ņØś Ļ▓Ćņ▓┤ļź╝ ļ┐īļ”¼Ļ│Ā ņØ╝ņĀĢ ņŗ£Ļ░ä ļåōņĢäļæÉņ¢┤ Ļ▓Ćņ▓┤ ņĢłņØś ņ×ÉĻ░ĆĒĢŁņ▓┤Ļ░Ć ņĪ░ņ¦üņŚÉ ņĪ┤ņ×¼ĒĢśļŖö ĒĢŁņøÉņŚÉ Ļ▓░ĒĢ®ĒĢśļÅäļĪØ ņ£ĀļÅäĒĢ£ ņØ┤Ēøä ĒÜ©ņåīļéś ĒśĢĻ┤æņØ┤ ļČÖņ¢┤ņ׳ļŖö ņØ┤ņ░©ĒĢŁņ▓┤ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĪ░ņ¦üņŚÉ Ļ▓░ĒĢ®ļÉ£ ĒÖśņ×ÉņØś ņ×ÉĻ░ĆĒĢŁņ▓┤ļź╝ ņ░ŠļŖö Ļ▓Ćņé¼ļ▓ĢņØ┤ļŗż. ņŗżĒŚśņźÉņØś ļćīĻ░Ć ļ¦ÄņØ┤ ņØ┤ņÜ®ļÉśļ®░ ĒĢ┤ļ¦ł, ņåīļćī, ļćīĻ░ä, ĻĖ░ņĀĆĒĢĄĻ│╝ ļīĆļćīĒö╝ņ¦łņØś ĒŖ╣ņĀĢ ņ£äņ╣śļéś ņäĖĒżņŚÉ ļČÖļŖö ĒĢŁņ▓┤ļź╝ ņ░ŠĻ│Ā ļ¦Éņ┤łņŗĀĻ▓ĮņŚÉņä£ļŖö ļ×æļ╣äņŚÉĻ▓░ņĀłņŚÉ Ļ▓░ĒĢ®ĒĢśļŖö ĒĢŁņ▓┤ļź╝ ņ░ŠļŖö ļŹ░ ņØ┤ņÜ®ĒĢĀ ņłś ņ׳ļŗż[25,26]. ņØ┤ Ļ▓Ćņé¼ļ▓Ģņ£╝ļĪ£ ĒŖ╣ņĀĢ ĻĄ¼ņĪ░ņŚÉ Ļ▓░ĒĢ®ĒĢśļŖö ņ×ÉĻ░ĆĒĢŁņ▓┤ņØś ņĪ┤ņ×¼ļź╝ ņ”Øļ¬ģĒĢĀ ņłś ņ׳ņ¦Ćļ¦ī ĒĢŁņøÉņØ┤ ņ¢┤ļ¢ż ļ¼╝ņ¦łņØĖņ¦ĆļŖö ĻĘ£ļ¬ģĒĢĀ ņłś ņŚåļŗż[27]. ĒĢŁņøÉņØä ĻĘ£ļ¬ģĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņØ┤ņ░©ņĀüņØĖ ĒĢŁņøÉ-ĒŖ╣ņØ┤ ļČäņäØļ▓ĢņØ┤ ĒĢäņÜöĒĢśļŗż. ĻĘĖļ”¼Ļ│Ā ņØ┤ Ļ▓Ćņé¼ļŖö ņłÖļĀ©ļÉ£ Ļ▓Ćņé¼ņ×ÉņŚÉ ņØśĒĢśņŚ¼ ņŗ£Ē¢ēļÉśĻ│Ā ĒĢ┤ņäØļÉśņ¢┤ņĢ╝ ĒĢśņŚ¼ ņØ╝ļČĆ Ļ▓Ćņé¼ņŗżņØ┤ļéś ņŚ░ĻĄ¼ņŗżņŚÉņä£ļ¦ī ņłśĒ¢ēļÉśĻ│Ā ņ׳ļŗż. ņŗĀņāØļ¼╝ļöĖļ”╝ĒĢŁņ▓┤ļź╝ ņ░ŠļŖö ļŹ░ ņØ┤ Ļ▓Ćņé¼ļ▓ĢņØ┤ ņØ┤ņÜ®ļÉ£ļŗż.
ņø©ņŖżĒä┤ļĖöļĪ»(western blot)ņØĆ ņóģņóģ ņäĖĒżņ¦ł Ēś╣ņØĆ ĒĢĄļé┤ ĒĢŁņøÉņŚÉ ļīĆĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ļź╝ ņĖĪņĀĢĒĢĀ ļĢī ņØ┤ņÜ®ļÉ£ļŗż[27]. ņØ┤ļōż ĒĢŁņøÉņŚÉ ļīĆĒĢ£ ĒĢŁņ▓┤ļŖö ņäĀĒśĢņØś ļ│Ćņä▒ļÉ£ ĒĢŁņøÉĻ▓░ņĀĢņØĖņ×É(linear denatured epitopes) ņŚÉļÅä ļ░śņØæņØä ĒĢśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ĒĢśņ¦Ćļ¦ī ņäĖĒżļ¦ē ļŗ©ļ░▒ ļō▒ ņäĖĒżļ░öĻ╣źĒĢŁņøÉņŚÉ ļīĆĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ļōżņØĆ ĒĢŁņøÉņØś 3ņ░©ņøÉ ĒśĢĒā£Ļ░Ć Ļ▓░ĒĢ®ņŚÉ ņżæņÜöĒĢ£ ņÜöņØĖņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ ņ×ÉĻ░ĆĒĢŁņ▓┤Ļ▓Ćņé¼ļ▓Ģņ£╝ļĪ£ ņø©ņŖżĒä┤ ļĖöļĪ»ņØĆ ņĀüņĀłĒĢśņ¦Ć ņĢŖļŗż.
ļ®┤ņŚŁļĖöļĪ»(immunoblot)ņØĆ ņóģņØ┤ņÖĆ Ļ░ÖņØĆ ļ¦ē(membrane)ņŚÉ ĒŖ╣ņĀĢ ĒĢŁņøÉļōżņØä ņĮöĒīģ(coating)ĒĢśĻ│Ā ĒÖśņ×ÉņØś Ļ▓Ćņ▓┤ņÖĆ ņØ┤ņ░©ĒĢŁņ▓┤ļź╝ ņł£ņ░©ņĀüņ£╝ļĪ£ ļ░śņØæņŗ£ņ╝£ ņ×ÉĻ░ĆĒĢŁņ▓┤ļź╝ ņ░ŠļŖö Ļ▓Ćņé¼ļ▓ĢņØ┤ļŗż[27]. Ļ▓Ćņé¼ļ▓ĢņØ┤ ļ╣äĻĄÉņĀü Ļ░äļŗ©ĒĢśĻ│Ā ņŚ¼ļ¤¼ ĒĢŁņøÉņŚÉ ļīĆĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ļź╝ ĒĢ£ ļ▓łņŚÉ Ļ▓Ćņé¼ĒĢĀ ņłś ņ׳ļŖö ņןņĀÉņØ┤ ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī ĒĢŁņ▓┤ņØś ņĀĢļ¤ēĒÖöĻ░Ć ņ¢┤ļĀżņÜ┤ ļŗ©ņĀÉņØ┤ ņ׳ļŗż. ņŗĀņāØļ¼╝ļöĖļ”╝ĒĢŁņ▓┤ Ļ▓Ćņé¼ļ▓ĢĻ│╝ ĻĖĖļף-ļ░öļĀłņ”ØĒøäĻĄ░, Ēö╝ņģöņ”ØĒøäĻĄ░, ļŗżņ┤łņĀÉņÜ┤ļÅÖņŗĀĻ▓Įļ│æņ”Ø ļō▒Ļ│╝ ņŚ░Ļ┤ĆļÉ£ ĒĢŁ-Ļ░ĢĻĖĆļ”¼ņśżņé¼ņØ┤ļō£ ĒĢŁņ▓┤ Ļ▓Ćņé¼ļ▓Ģņ£╝ļĪ£ ņØ┤ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ņø©ņŖżĒä┤ļĖöļĪ»ļÅä Ēü¼Ļ▓īļŖö ļ®┤ņŚŁļĖöļĪ»ņØś ĒĢ£ ņóģļźśļĪ£ ĻĄ¼ļČäĒĢĀ ņłśļÅä ņ׳ņ£╝ļ®░, ļŗ©ļ░▒ņ¦ł ĒĢŁņøÉņØä ļ¦ēņŚÉ Ļ│ĀņĀĢĒĢśļŖö ļ░®ļ▓ĢņØ┤ ņĀäĻĖ░ņśüļÅÖņØ┤ļØ╝ļŖö ņĀÉņØ┤ ņĢ×ņØś ļ®┤ņŚŁļĖöļĪ»Ļ│╝ļŖö ļŗżļźĖ ņĀÉņØ┤ļŗż.
ļ░®ņé¼ņäĀļ®┤ņŚŁņ╣©ņĀäļČäņäØļ▓Ģ(radioimmunoprecipitation assay)ņØĆ ļ░®ņé¼ņä▒ļÅÖņ£äņøÉņåīļĪ£ Ēæ£ņ¦ĆļÉ£ ĒŖ╣ņĀĢ ĒĢŁņøÉņŚÉ ĒÖśņ×ÉņØś Ļ▓Ćņ▓┤ļź╝ ļäŻņ¢┤ ĒĢŁņøÉ-ĒĢŁņ▓┤ ļ░śņØæņØä ņ£ĀļÅäĒĢśĻ│Ā ĒĢŁņøÉ-ĒĢŁņ▓┤ ļ│ĄĒĢ®ņ▓┤ņØś ļ░®ņé¼ņäĀņ¢æņØä ņĖĪņĀĢĒĢśņŚ¼ ņ×ÉĻ░ĆĒĢŁņ▓┤ļź╝ ņ░ŠļŖö Ļ▓Ćņé¼ņØ┤ļŗż[27]. ņØ┤ ļČäņäØļ▓ĢņŚÉņä£ ĒĢŁņøÉ-ĒĢŁņ▓┤ ļ░śņØæņØĆ ņĢĪņ▓┤ ņåŹņŚÉņä£ ņØ╝ņ¢┤ļé£ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ļ»╝Ļ░ÉļÅä, ĒŖ╣ņØ┤ļÅä, ņ×¼Ēśäņä▒ņØ┤ ļåÆĻ│Ā ņ×ÉĻ░ĆĒĢŁņ▓┤ņØś ņĀĢļ¤ēĒÖöĻ░Ć Ļ░ĆļŖźĒĢ£ ņןņĀÉņØ┤ ņ׳ņ£╝ļ®░ ĒĢŁ-ņĢäņäĖĒŗĖņĮ£ļ”░ņłśņÜ®ņ▓┤ ĒĢŁņ▓┤ņÖĆ ĒĢŁ-MuSK ĒĢŁņ▓┤ Ļ▓Ćņé¼ļ▓Ģņ£╝ļĪ£ ņØ┤ņÜ®ļÉ£ļŗż.
ĒÜ©ņåīĻ▓░ĒĢ®ļ®┤ņŚŁĒØĪņ░®ņĖĪņĀĢļ▓Ģ(enzyme-linked immunosorbent assays, ELISA)ņØĆ ļ│┤ĒåĄ ļ░öļŗźņØ┤ Ēł¼ļ¬ģĒĢ£ ļ¦łņØ┤Ēü¼ļĪ£ĒöīļĀłņØ┤ĒŖĖ(96 or 384 well microplate) ļ░öļŗźņŚÉ ĒŖ╣ņĀĢ ĒĢŁņøÉņØä ĒØĪņ░®ņŗ£ņ╝£ ļåōņØĆ ņāüĒā£ņŚÉņä£ ĒÖśņ×ÉņØś Ļ▓Ćņ▓┤ļź╝ ļäŻņ¢┤ ĒĢŁņøÉ-ĒĢŁņ▓┤ Ļ▓░ĒĢ®ņØä ņ£ĀļÅäĒĢ£ ņØ┤Ēøä ĒÜ©ņåīĻ░Ć Ļ▓░ĒĢ®ļÉ£ ņØ┤ņ░©ĒĢŁņ▓┤ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ×ÉĻ░ĆĒĢŁņ▓┤ļź╝ ņĖĪņĀĢĒĢ£ļŗż. ELISAļŖö Ļ▓Ćņé¼ ņŗ£Ē¢ē ļ░®ļ▓ĢņØ┤ ļ╣äĻĄÉņĀü Ļ░äļŗ©ĒĢśĻ│Ā ļ╣Āļź┤Ļ▓ī Ļ▓░Ļ│╝ļź╝ ņ¢╗ņØä ņłś ņ׳ņ¢┤ ļäÉļ”¼ ņé¼ņÜ®ļÉśņ¦Ćļ¦ī ņ£äņ¢æņä▒(false-positive) Ļ▓░Ļ│╝ļź╝ ņŻ╝ņØśĒĢĀ ĒĢäņÜöĻ░Ć ņ׳ļŗż[27].
ņäĖĒżĻĖ░ļ░śļČäņäØļ▓Ģ(cell-based assay)ņØĆ ņé┤ņĢäņ׳ļŖö ņäĖĒżņŚÉ ĒŖ╣ņĀĢ ĒĢŁņøÉņŚÉ ļīĆĒĢ£ ņ£ĀņĀäņ×Éļź╝ ĒśĢņ¦łņŻ╝ņ×ģ(transfection)ĒĢśņŚ¼ ĒĢŁņøÉņØä ļ░£Ēśäņŗ£ĒéżĻ│Ā ĻĘĖ ĒĢŁņøÉņŚÉ ļīĆĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ļź╝ ĒÖśņ×ÉņØś Ļ▓Ćņ▓┤ņŚÉņä£ ņ░ŠļŖö Ļ▓Ćņé¼ļ▓ĢņØ┤ļŗż[27]. ņäĖĒżļĪ£ļŖö ņŻ╝ļĪ£ HEK293 ņäĖĒżĻ░Ć ĻĘĖļ”¼Ļ│Ā ĒĢŁņøÉņØĆ ņŻ╝ļĪ£ ņäĖĒżļ¦ēņŚÉ ļ░£ĒśäļÉśļŖö ļŗ©ļ░▒ ĒĢŁņøÉņØä ņØ┤ņÜ®ĒĢ£ļŗż. ņé┤ņĢäņ׳ļŖö ņäĖĒżļ¦ēņŚÉ Ļ┤Ćņŗ¼ ĒĢŁņøÉņØ┤ ņāØļ”¼ņĀüņØĖ ĒśĢĒā£ļīĆļĪ£ ļ░£ĒśäļÉśņ¢┤ ņ¦łļ│æ-ĒŖ╣ņØ┤ ņ×ÉĻ░ĆĒĢŁņ▓┤ļź╝ ņ░ŠļŖö ļŹ░ ņ£ĀņÜ®ĒĢśĻ▓ī ņØ┤ņÜ®ļÉ£ļŗż. ņØ┤ Ļ▓Ćņé¼ ņŗ£Ē¢ēņŚÉļŖö ņäĖĒżļ░░ņ¢æ, ņäĖĒżĒśĢņ¦łļ│ĆĒÖś, ļ®┤ņŚŁĒśĢĻ┤æņŚ╝ņāē ļō▒ņØś ļ│Ąņ×ĪĒĢ£ Ļ│╝ņĀĢņØ┤ ĒĢäņÜöĒĢśņŚ¼ ņåīņłśņØś ņŗżĒŚśņŗżņŚÉņä£ Ļ▓Ćņé¼Ļ░Ć ņłśĒ¢ēļÉśĻ│Ā ņ׳ļŗż[28]. ņØ╝ļČĆ ņ×ÉĻ░ĆĒĢŁņ▓┤(ņśł, ĒĢŁ-ņĢäņ┐ĀņĢäĒżļ”░4 ĒĢŁņ▓┤)ņŚÉ ļīĆĒĢ┤ņä£ļŖö ĒĢŁņøÉņØ┤ ļ░£ĒśäļÉ£ ņäĖĒżļź╝ Ļ│ĀņĀĢ(fixation)ĒĢśņŚ¼ ņĀ£ņ×æļÉ£ Ļ▓Ćņé¼ĒéżĒŖĖļź╝ ĻĄ¼ĒĢĀ ņłś ņ׳ņ¢┤ ņ¦äļŻīņŚÉ ņØ┤ņÜ®ļÉśĻ│Ā ņ׳ļŗż.
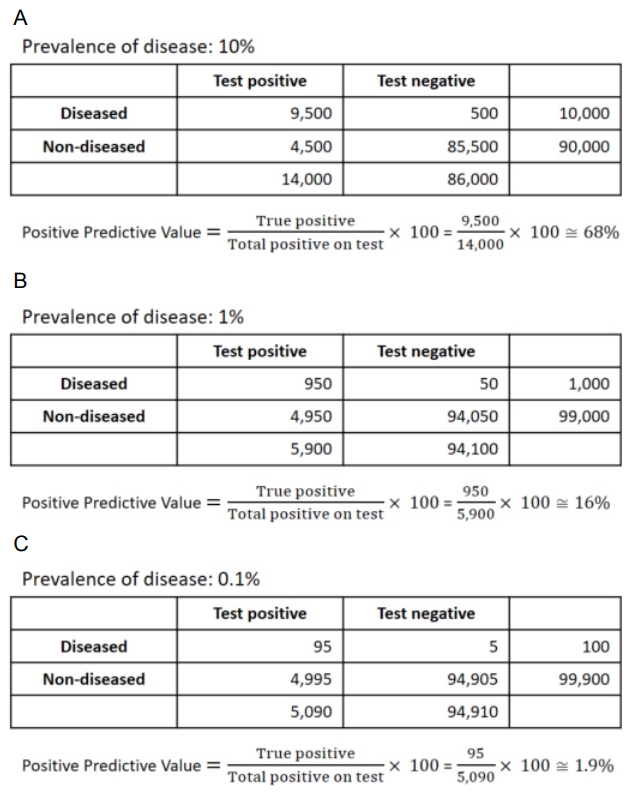
ņ¦äļŻī ĒśäņןņŚÉņä£ ņ×ÉĻ░ĆĒĢŁņ▓┤Ļ▓Ćņé¼ļź╝ ņ▓śļ░®ĒĢśļ®┤ņä£ ņ¦äļŻīņØśņé¼ļōżņØĆ ŌĆ£Ļ▓Ćņé¼ Ļ▓░Ļ│╝Ļ░Ć ņ¢æņä▒ņØ┤ļØ╝ļ®┤ ņ×ÉĻ░Ćļ®┤ņŚŁ ņŗĀĻ▓ĮĻĘ╝ņ£Īņ¦łĒÖśņØ╝ Ļ░ĆļŖźņä▒ņØĆ ņ¢╝ļ¦łļéś ļÉĀĻ╣ī?ŌĆØļØ╝ļŖö ņ¦łļ¼ĖņØä ĒĢĀ Ļ▓āņØ┤ļŗż. Ļ▓Ćņé¼ Ļ▓░Ļ│╝Ļ░Ć ņ¢æņä▒ņØ╝ ļĢī Ļ▓Ćņé¼ļź╝ ļ░øņØĆ ņé¼ļ×īņØ┤ ņŗżņĀ£ļĪ£ ĒĢ┤ļŗ╣ ņ¦łĒÖśņØä ņ¦ĆļŗłĻ│Ā ņ׳ņØä ĒÖĢļźĀņØ┤ ņ¢æņä▒ņśłņĖĪņ╣śņØ┤ļŗż. ĻĘĖļ¤░ļŹ░ ņ¢æņä▒ņśłņĖĪņ╣śļŖö Ļ▓Ćņé¼ņØś ļ»╝Ļ░ÉļÅäņÖĆ ĒŖ╣ņØ┤ļÅäļ┐Éļ¦ī ņĢäļŗłļØ╝ ĒĢ┤ļŗ╣ ņ¦łļ│æņØś ņ£Āļ│æļźĀņŚÉļÅä ņśüĒ¢źņØä ļ░øļŖöļŗż. ņ£Āļ│æļźĀņØ┤ ņ¢æņä▒ņśłņĖĪņ╣śņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØä ņé┤ĒÄ┤ļ│┤ĻĖ░ ņ£äĒĢśņŚ¼ ļ»╝Ļ░ÉļÅäņÖĆ ĒŖ╣ņØ┤ļÅä ļ¬©ļæÉ 95%ņØĖ Ļ▓Ćņé¼ļ▓Ģ AĻ░Ć ņ׳ļŗżĻ│Ā Ļ░ĆņĀĢĒĢśĻ▓Āļŗż. ņØ┤ļĢī 10ļ¦ī ļ¬ģņØś ņØĖĻĄ¼ ņ¦æļŗ©ņŚÉņä£ ņ£Āļ│æļźĀņØ┤ 10%ņØĖ ņ¦łĒÖśņŚÉ Ļ▓Ćņé¼ļ▓Ģ Aļź╝ ņĀüņÜ®ĒĢ£ļŗżĻ│Ā ĒĢśļ®┤ ņ¢æņä▒ņśłņĖĪņ╣śļŖö ņĢĮ 68%ņØ┤ļŗż(Fig. 2A). ĻĘĖļ¤░ļŹ░ ņ£Āļ│æļźĀņØ┤ 1%ļØ╝Ļ│Ā ĒĢśļ®┤ ņ¢æņä▒ņśłņĖĪņ╣śļŖö ņĢĮ 16%ņØ┤Ļ│Ā(Fig. 2B) ņ£Āļ│æļźĀņØ┤ 0.1%ņØĖ Ļ▓ĮņÜ░ņŚÉļŖö ņ¢æņä▒ņśłņĖĪņ╣śĻ░Ć ņĢĮ 1.9%ņØ┤ļŗż(Fig. 2C). ņØ┤ļĀćļō» ņ£Āļ│æļźĀņØ┤ ļé«ņØä ņłśļĪØ Ļ▓Ćņé¼Ļ░Ć ņ¢æņä▒ņØ┤ņ¢┤ļÅä Ļ▓Ćņé¼ļź╝ ļ░øņØĆ ņé¼ļ×īņØ┤ ņŗżņĀ£ļĪ£ ņ¦łĒÖśņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņØä ĒÖĢļźĀņØĆ ļé«ņĢäņ¦ĆĻ▓ī ļÉ£ļŗż. ņ×ÉĻ░ĆĒĢŁņ▓┤ņÖĆ ņŚ░Ļ┤ĆļÉ£ ņŗĀĻ▓ĮĻĘ╝ņ£Īņ¦łĒÖśļōżņØĆ Ļ▒░ņØś ļīĆļČĆļČä ņ£Āļ│æļźĀņØ┤ ļ¦żņÜ░ ļé«ļŗż. ņżæņ”ØĻĘ╝ļ¼┤ļĀźņ”ØņØś ņ£Āļ│æļźĀņØĆ ņØĖĻĄ¼ 100ļ¦ī ļ¬ģļŗ╣ 15-179ļ¬ģņØ┤ļ®░, ļ¦īņä▒ņŚ╝ņ”Ø Ēāłņłśņ┤łņŗĀĻ▓Įļ│æņ”ØņØś ņ£Āļ│æļźĀņØĆ ņØĖĻĄ¼ 100ļ¦ī ļ¬ģļŗ╣ 6.7-77ļ¬ģņ£╝ļĪ£ ņ£Āļ│æļźĀņØ┤ 0.1%ļ│┤ļŗż Ēø©ņö¼ ļé«ļŗż.29-31 ļö░ļØ╝ņä£ ņØ┤ļōż ņ¦łĒÖśņŚÉņä£ ņ×ÉĻ░ĆĒĢŁņ▓┤Ļ▓Ćņé¼ļōżņØś ņ¢æņä▒ņśłņĖĪņ╣śļŖö ļ¦żņÜ░ ļé«ņØĆ ņłśņżĆņØ╝ Ļ▓āņØ┤ļŗż. ņØ┤ļŖö ņ×äņāü ņ¢æņāüņØä Ļ│ĀļĀżĒĢśņ¦Ć ņĢŖĻ│Ā Ļ▓Ćņé¼ Ļ▓░Ļ│╝ļ¦īņ£╝ļĪ£ ņ¦äļŗ©ņØä ļé┤ļ”¼ļŖö ņāüĒÖ®ņØ┤ ļ░öļ×īņ¦üĒĢśņ¦Ć ņĢŖļŗżļŖö Ļ▓āņØä ļ│┤ņŚ¼ņżĆļŗż. ņŗĀĻ▓ĮĻĘ╝ņ£Īņ¦łĒÖśņŚÉņä£ ņ×ÉĻ░ĆĒĢŁņ▓┤Ļ▓Ćņé¼ļź╝ ņ▓śļ░®ĒĢśĻ│Ā Ļ▓Ćņé¼ Ļ▓░Ļ│╝ļź╝ ĒĢ┤ņäØĒĢĀ ļĢīļŖö ĒĢŁņāü ĒÖśņ×ÉņØś ņ×äņāü ņ¢æņāüņØä Ļ│ĀļĀżĒĢśņŚ¼ ņ×ÉĻ░ĆĒĢŁņ▓┤ ņŚ░Ļ┤Ć ņ¦łĒÖśņØś Ļ░ĆļŖźņä▒ņØ┤ ļåÆņØä ļĢī ņ×ÉĻ░ĆĒĢŁņ▓┤Ļ▓Ćņé¼ļź╝ ņ▓śļ░®ĒĢśņŚ¼ņĢ╝ ĒĢśļ®░, Ļ▓Ćņé¼ Ļ▓░Ļ│╝Ļ░Ć ņ¢æņä▒ņØ╝ Ļ▓ĮņÜ░ ņ£äņ¢æņä▒ņŚÉ ļīĆĒĢ£ Ļ░ĆļŖźņä▒ņØä Ļ▓ĆĒåĀĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż.
ĒĢŁņ▓┤ļŖö ļ¦żņÜ░ ļŗżņ¢æĒĢ£ ļ¼╝ņ¦łņŚÉ Ļ▓░ĒĢ®ĒĢśļ®░ ļ®┤ņŚŁņŚÉņä£ ļ¦żņÜ░ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ņ¦ĆļŗłĻ│Ā ņ׳ļŗż. ĻĘĖļ¤░ļŹ░ ĒĢŁņ▓┤ņØś ĒĢĄņŗ¼ ĒŖ╣ņä▒ņØĖ ļŗżņ¢æņä▒ņ£╝ļĪ£ ņØĖĒĢśņŚ¼ ņÜ░ļ”¼ ļ¬ĖņØä ĻĄ¼ņä▒ĒĢśļŖö ņĀĢņāüņĀüņØĖ ļ¼╝ņ¦łņŚÉ ļīĆĒĢ£ ĒĢŁņ▓┤Ļ░Ć ļ¦īļōżņ¢┤ņ¦Ćļ®░ ņØ┤ļź╝ ņ×ÉĻ░ĆĒĢŁņ▓┤ļØ╝ ļČĆļźĖļŗż. ņ×ÉĻ░ĆĒĢŁņ▓┤ņŚÉ ņØśĒĢśņŚ¼ ļ¦Éņ┤łņŗĀĻ▓Į, ņŗĀĻ▓ĮĻĘ╝ņ£ĪņĀæĒĢ®ļČĆ ĻĘĖļ”¼Ļ│Ā ĻĘ╝ņ£ĪņØś ņåÉņāüņØ┤ļéś ĻĖ░ļŖźņĀĆĒĢśĻ░Ć ņ£Āļ░£ļÉĀ ņłś ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ņÖĆ ņŚ░Ļ┤ĆļÉ£ ņŗĀĻ▓ĮĻĘ╝ņ£Īņ¦łĒÖśļōżņŚÉņä£ ņ×ÉĻ░ĆĒĢŁņ▓┤ņØś ĒÖĢņØĖņØĆ ņ¦äļŗ©Ļ│╝ ņ╣śļŻīņŚÉ Ēü░ ļÅäņøĆņØ┤ ļÉ£ļŗż. ņŗĀĻ▓ĮĻĘ╝ņ£Īņ¦łĒÖś ĒÖśņ×Éļź╝ ņ¦äļŻīĒĢśļŖö ņØśņé¼ļōżņØ┤ ĒÖśņ×ÉņØś ņ×äņāü ņ¢æņāüņØä ĒÖĢņØĖĒĢ£ ņØ┤Ēøä ņ×ÉĻ░ĆĒĢŁņ▓┤ ņŚ░Ļ┤Ć ņ¦łĒÖśņØ┤ ņØśņŗ¼ļÉĀ Ļ▓ĮņÜ░ ņĀüņĀłĒĢ£ Ļ▓Ćņé¼ļ▓ĢņØä ņäĀĒāØĒĢśĻ│Ā Ļ▓░Ļ│╝ļź╝ ĒĢ┤ņäØĒĢśļŖö ļŖźļĀźņŚÉ ņ×ÉĻ░ĆĒĢŁņ▓┤ņŚÉ ļīĆĒĢ£ ņØ┤ĒĢ┤Ļ░Ć ļ░śļō£ņŗ£ ĒĢäņÜöĒĢśļŗż.
Acknowledgments
This work was supported by the National Research Foundation of Korea (NRF) grant funded by the Korean government (MSIT) (No. NRF-2020R1C1C1010130).
Fig.┬Ā1.
The structure of the antibody. Fab, antigen binding fragment; Fc, crystallizable fragment; VH, variable region of heavy chain; VL, variable region of light chain; CH, constant region of heavy chain; CL, constant region of light chain.
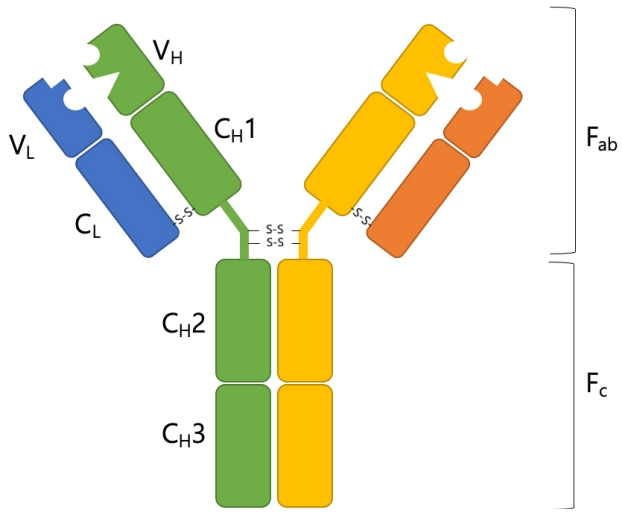
Fig.┬Ā2.
The effect of prevalence on the positive predictive value. A test having 95% sensitivity and 95% specificity shows positive predictive value of (A) 68% in a population with a prevalence of 10%, (B) 16% in a population with a prevalence of 1%, and (C) 1.9% in a population with a prevalence of 0.1%.
REFERENCES
1. Sun B, Ramberger M, O'Connor KC, Bashford-Rogers RJM, Irani SR. The B cell immunobiology that underlies CNS autoantibodymediated diseases. Nat Rev Neurol 2020;16:481-492.




2. Theofilopoulos AN, Kono DH, Baccala R. The multiple pathways to autoimmunity. Nat Immunol 2017;18:716-724.




3. Casadevall A, Pirofski LA. A new synthesis for antibody-mediated immunity. Nat Immunol 2011;13:21-28.




4. Woof JM, Burton DR. Human antibody-Fc receptor interactions illuminated by crystal structures. Nat Rev Immunol 2004;4:89-99.



5. Xu Z, Zan H, Pone EJ, Mai T, Casali P. Immunoglobulin class-switch DNA recombination: induction, targeting and beyond. Nat Rev Immunol 2012;12:517-531.




6. Bruhns P. Properties of mouse and human IgG receptors and their contribution to disease models. Blood 2012;119:5640-5649.



7. Meffre E. The establishment of early B cell tolerance in humans: lessons from primary immunodeficiency diseases. Ann N Y Acad Sci 2011;1246:1-10.



8. Tiller T, Tsuiji M, Yurasov S, Velinzon K, Nussenzweig MC, Wardemann H. Autoreactivity in human IgG+ memory B cells. Immunity 2007;26:205-213.



9. Tsuiji M, Yurasov S, Velinzon K, Thomas S, Nussenzweig MC, Wardemann H. A checkpoint for autoreactivity in human IgM+ memory B cell development. J Exp Med 2006;203:393-400.




10. Wardemann H, Yurasov S, Schaefer A, Young JW, Meffre E, Nussenzweig MC. Predominant autoantibody production by early human B cell precursors. Science 2003;301:1374-1377.


11. Burbelo PD, Iadarola MJ, Keller JM, Warner BM. Autoantibodies targeting intracellular and extracellular proteins in autoimmunity. Front Immunol 2021;12:548469.



12. Dalakas MC. IgG4-mediated neurologic autoimmunities: understanding the pathogenicity of IgG4, ineffectiveness of IVIg, and long-lasting benefits of anti-B cell therapies. Neurol Neuroimmunol Neuroinflamm 2021;9:e1116.



13. Kieseier BC, Mathey EK, Sommer C, Hartung HP. Immune-mediated neuropathies. Nat Rev Dis Primers 2018;4:31.



14. Uncini A, Kuwabara S. Nodopathies of the peripheral nerve: an emerging concept. J Neurol Neurosurg Psychiatry 2015;86:1186-1195.


15. Vincent A. Autoantibodies in neuromuscular transmission disorders. Ann Indian Acad Neurol 2008;11:140-145.



16. Williams JP, Carlson NG, Greenlee JE. Antibodies in autoimmune human neurological disease: pathogenesis and immunopathology. Semin Neurol 2018;38:267-277.


17. Lancaster E, Dalmau J. Neuronal autoantigens--pathogenesis, associated disorders and antibody testing. Nat Rev Neurol 2012;8:380-390.




18. Neufing PJ, Clancy RM, Jackson MW, Tran HB, Buyon JP, Gordon TP. Exposure and binding of selected immunodominant La/SSB epitopes on human apoptotic cells. Arthritis Rheum 2005;52:3934-3942.


19. Lundberg IE, Fujimoto M, Vencovsky J, Aggarwal R, Holmqvist M, Christopher-Stine L, et al. Idiopathic inflammatory myopathies. Nat Rev Dis Primers 2021;7:86.



20. Silverman GJ, Vas J, Gr├Čnwall C. Protective autoantibodies in the rheumatic diseases: lessons for therapy. Nat Rev Rheumatol 2013;9:291-300.



21. Saiki O, Saeki Y, Tanaka T, Doi S, Hara H, Negoro S, et al. Development of selective IgM deficiency in systemic lupus erythematosus patients with disease of long duration. Arthritis Rheum 1987;30:1289-1292.


22. Sivri A, Has├¦elik Z. IgM deficiency in systemic lupus erythematosus patients. Arthritis Rheum 1995;38:1713.

23. Asakura K, Pogulis RJ, Pease LR, Rodriguez M. A monoclonal autoantibody which promotes central nervous system remyelination is highly polyreactive to multiple known and novel antigens. J Neuroimmunol 1996;65:11-19.


24. Paz Sold├Īn MM, Warrington AE, Bieber AJ, Ciric B, Van Keulen V, Pease LR, et al. Remyelination-promoting antibodies activate distinct Ca2+ influx pathways in astrocytes and oligodendrocytes: relationship to the mechanism of myelin repair. Mol Cell Neurosci 2003;22:14-24.


25. Querol L, Nogales-Gadea G, Rojas-Garcia R, Diaz-Manera J, Pardo J, Ortega-Moreno A, et al. Neurofascin IgG4 antibodies in CIDP associate with disabling tremor and poor response to IVIg. Neurology 2014;82:879-886.



26. Wilkinson PC, Zeromski J. Immunofluorescent detection of antibodies against neurones in sensory carcinomatous neuropathy. Brain 1965;88:529-583.


27. Waters P, Pettingill P, Lang B. Detection methods for neural autoantibodies. Handb Clin Neurol 2016;133:147-163.


28. Kim MJ, Kim SW, Kim M, Choi YC, Kim SM, Shin HY. Evaluating an in-house cell-based assay for detecting antibodies against muscle-specific tyrosine kinase in myasthenia gravis. J Clin Neurol 2021;17:400-408.




29. Broers MC, Bunschoten C, Nieboer D, Lingsma HF, Jacobs BC. Incidence and prevalence of chronic inflammatory demyelinating polyradiculoneuropathy: a systematic review and meta-analysis. Neuroepidemiology 2019;52:161-172.




-
METRICS

-
- 0 Crossref
- Scopus
- 1,901 View
- 30 Download
- Related articles in Korean J Neuromuscul Disord
-
Acute Neuromuscular Respiratory Failure2023 June;15(1)
Muscle and Nerve Biopsy in Various Neuromuscular Disorders2022 June;14(1)
Immunotherapy for Autoimmune Neuromuscular Diseases2015 December;7(2)
Treatment of Neuromuscular Junction Disorders2014 June;6(1)
Anatomy and Physiology of Neuromuscular Junction2014 June;6(1)





